ポイント
- 肥満に伴い肝臓などに脂肪が蓄積すると、糖代謝異常が生じる。
- 病原体センサー分子のMincle(ミンクル)が脂肪組織の線維化を引き起こし、肝臓などに脂肪を蓄積させることを発見。
- Mincleを標的とするメタボリックシンドロームの新たな分子機構を解明。
JST 戦略的創造研究推進事業において、東京医科歯科大学 大学院医歯学総合研究科の菅波 孝祥 特任教授は、小川 佳宏 教授らと共同で、Mincle注1)と呼ばれる病原体センサー分子が肥満に伴う脂肪組織の線維化を促進させる鍵となる因子であること、“第三の脂肪”ともいわれる異所性脂肪注2)の蓄積に重要な役割を担うことを明らかにしました。
脂肪組織は、余剰エネルギーを中性脂肪として貯蔵する機能のほかに、種々のホルモンを分泌する機能も持ちます。これまでに肥満に伴って脂肪組織で慢性炎症が生じることが分かっていますが、最近、慢性炎症の結果、ホルモン産生調節が破綻することでメタボリックシンドローム注3)を発症することが明らかになりました。一方、慢性炎症に伴うエネルギー貯蔵機能の変化もメタボリックシンドローム発症に関与するものと考えられていますが、詳しい分子機構は分かっていませんでした。
菅波特任教授らは、肥満の脂肪組織に形成される特徴的な組織学的構造(CLS:王冠様構造注4))中に、Mincle分子が高発現することを見いだしました。CLSには免疫担当細胞が集まっており、慢性炎症の起点になります。
さらに、Mincleを欠損させたマウスに高脂肪食を与えて肥満にさせると、野生型マウスに比べて、CLS形成とそれに伴う組織の線維化が少なく、脂肪蓄積能が保たれるとともに、肝臓への脂肪の蓄積や糖代謝異常が軽減されることが分かりました。また、非肥満マウスの脂肪組織でMincleを活性化させたところ、CLSの形成と脂肪組織の線維化が誘導されました。
本研究により、今後、Mincleシグナルを標的とする新たなメタボリックシンドロームの治療戦略の開発が期待されます。
本研究成果は、2014年9月19日(英国時間)に英国の科学誌「Nature Communications」でオンライン公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「炎症の慢性化機構の解明と制御
(研究総括:高津 聖志 富山県薬事研究所 所長)
|
| 研究課題名 |
「代謝ストレスによる炎症の慢性化機構の解明」 |
| 研究者 |
菅波 孝祥(東京医科歯科大学 大学院医歯学総合研究科 臓器代謝ネットワーク講座 特任教授) |
| 研究期間 |
平成24年10月~平成28年3月 |
<研究の背景と経緯>
近年のライフスタイルの欧米化に伴って、日本においても、肥満を中心とするメタボリックシンドロームやそれに伴う糖尿病、虚血性心疾患が増加し、大きな社会問題となっています。脂肪組織は、余剰エネルギーを中性脂肪として貯蔵する“代謝臓器”としての機能と、ホルモン(具体的にはアディポサイトカイン注5))を産生する“内分泌臓器”としての機能を持っています。これまでの多くの研究により、肥満が脂肪組織の内分泌臓器としての機能に影響を与え、疾患の発症リスクをもたらす仕組みが明らかになってきています。つまり、肥満に伴って、脂肪組織に特徴的な組織学的構造(CLS:王冠様構造)が現れます。CLS内部では、細胞死に陥った脂肪細胞を免疫担当細胞が取り囲んで貪食・処理しており、このCLSを中心として脂肪組織の慢性炎症が生じます。その結果、脂肪組織の線維化が起こり、アディポサイトカインの産生調節機能(内分泌機能)が障害されることで、糖尿病や虚血性心疾患のリスクが高まります。
一方で、肥満が、脂肪細胞の代謝臓器としての機能に与える影響は、充分明らかではありません。肥満の進展に伴う脂肪組織の慢性炎症は、脂肪蓄積能をも低下させると考えられています。また、この低下は、肝臓など本来少量しか脂肪の無い臓器への脂肪蓄積の増加につながると考えられています。しかし、脂肪組織のCLSを中心とした脂肪組織局所の慢性炎症が、脂肪の蓄積に果たす役割は不明でした。
<研究の内容>
菅波特任教授らは以前、肥満マウスの脂肪組織において、結核菌や真菌に対する病原体センサー分子であるMincleが高発現することを報告しました。今回、Mincleの発現を詳しく調べたところ、皮下脂肪組織と比較して内臓脂肪組織に多く認められ、肥満の進展とともに発現量が上昇することが明らかになりました。その中でもMincleの発現は、CLSを形成する免疫担当細胞「炎症促進性M1マクロファージ注6)」に選択的に認められました(図1)。
次に、肥満の脂肪組織炎症におけるMincleの役割を調べるために、Mincle欠損マウスと野生型マウスに高脂肪食を与えて、肥満を誘導しました。両者は同程度の体重増加を示しましたが、対照の野生型マウスと比較してMincle欠損マウスでは以下の点が異なっていました。(1)CLSの形成数の減少(図2)や(2)慢性炎症の結果として生じる組織の線維化の減少が認められ(図3)、(3)また脂肪細胞径が大きく、脂肪蓄積能が増加していることが示唆されました(図4)。一方、(4)肝臓の脂肪蓄積は顕著に抑制され(図5)、(5)全身の糖代謝も良好に保たれました(図6)。このように、Mincle欠損マウスでは、脂肪組織の慢性炎症が軽減した結果、肝臓に異所性脂肪蓄積とそれに伴う糖代謝異常の発症が抑制されたと想定されます。
そこで試験管内で培養した培養マクロファージに、Mincleを活性化するTDM(トハレロースジミコール酸:結核菌由来糖脂質)注7)を投与し、遺伝子発現の変化を検討しました。その結果、TGF-β注8)などの組織線維化にかかわる遺伝子群が顕著に誘導されることが明らかになりました。組織線維化におけるMincle活性化の役割を確認するため、TDMを非肥満マウスの脂肪組織に直接投与したところ、それだけでCLSが形成され、組織の線維化が誘導されました(図7)。これは、マクロファージにおけるMincleの活性化のみでも、脂肪組織の線維化を引き起こすのに十分であることを示しています。
<今後の展開>
本研究により、Mincleが脂肪組織炎症を促進させる鍵となる因子であること、肝臓などへの脂肪蓄積を介して全身の糖代謝においても重要な役割を担うことが初めて明らかになりました。
実際の体内では、CLSの形成と慢性炎症の発生・悪化、線維化は、互いに影響を及ぼし合い、悪循環を形成していると考えられています。本研究では、MincleをTDM投与によって活性化しましたが、実際には細胞死に陥った脂肪細胞から産生される何らかの未知の因子がMincleを活性化させ、脂肪組織における慢性炎症を悪化させると想定されます(図8)。今後、このMincle活性化分子を同定することにより、メタボリックシンドロームにおける慢性炎症の新たな分子機構が明らかになり、Mincleシグナルを標的とするメタボリックシンドローム治療戦略の開発につながることが期待されます。
また、欧米人と比較して日本人は、肥満の程度が軽い一方、肝臓の脂肪蓄積をきたしやすいことが知られています。このことは、日本人より欧米人の脂肪組織の脂肪蓄積能が髙いために、肝臓の脂肪蓄積が起こりにくいことを示唆しています。今後、本研究で明らかになったメカニズムがヒトにおいてどの程度関与しているのか、また、人種による脂肪蓄積能の違いを説明できるのか、今後の臨床研究による検証が待たれます。
<付記>
本研究は、九州大学 生体防御医学研究所の山崎 晶 教授らと共同で実施しました。
<参考図>
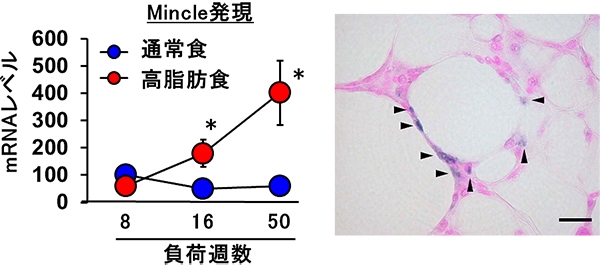
図1 肥満の脂肪組織におけるMincleの発現上昇
- 左図)高脂肪食を与えマウスに肥満を誘導すると、脂肪組織におけるMincleのmRNA量が経時的に上昇した。(通常食群に対して有意差あり*P<0.05)
- 右図)肥満の脂肪組織において、CLSを形成するマクロファージが選択的にMincle発現(青色)を認めた(矢印)。
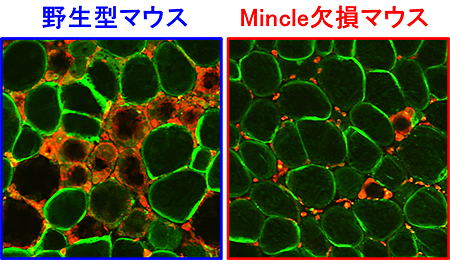
図2 Mincle欠損マウスにおける脂肪組織CLS形成数の減少
高脂肪食を与えた実験において、Mincle欠損マウスの脂肪組織では、細胞死に陥った脂肪細胞をマクロファージが取り囲むCLS像の形成数が少なかった(図中の緑:脂肪細胞、赤:マクロファージ)。
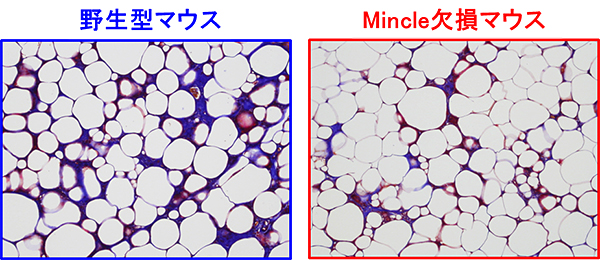
図3 Mincle欠損マウスにおける脂肪組織線維化の抑制
高脂肪食を与えた実験において、野生型マウスと比較し、Mincle欠損マウスの脂肪組織における線維化が抑制された(図中の青:線維化領域)。
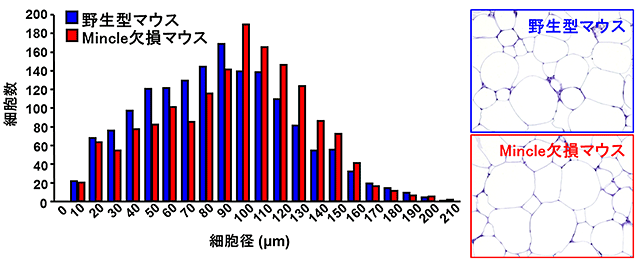
図4 Mincle欠損マウスにおける脂肪細胞の肥大化
高脂肪食を与えた実験において、野生型マウスと比較し、Mincle欠損マウスの脂肪細胞径は大きく、脂肪蓄積能が増加していることが示唆される。
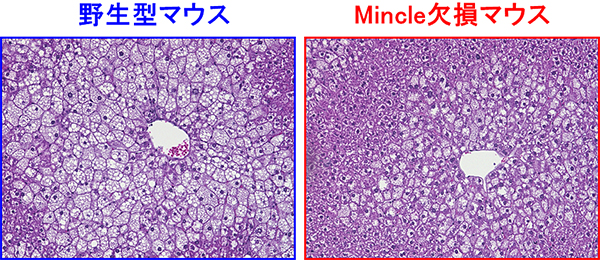
図5 Mincle欠損マウスにおける肝臓の異所性脂肪蓄積の抑制
高脂肪食を与えた実験において、野生型マウスと比較し、Mincle欠損マウスにおける脂肪肝が顕著に軽減した。細胞内の白く抜けている部分に脂肪が蓄積している(図中の紫:肝臓細胞)。
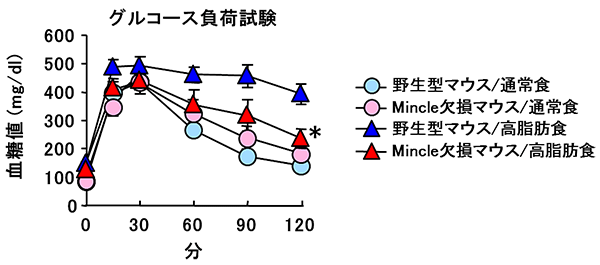
図6 Mincle欠損マウスにおける糖代謝の改善
高脂肪食飼育時に、Mincle欠損マウスは野生型マウスより良好な耐糖能(グルコース投与後における素早い血糖値の低下)を示した。一方、通常食飼育時は、Mincle欠損マウスと野生型マウスの間に明らかな差を認めなかった。(野生型マウス/高脂肪食に対し有意差あり*P<0.05)
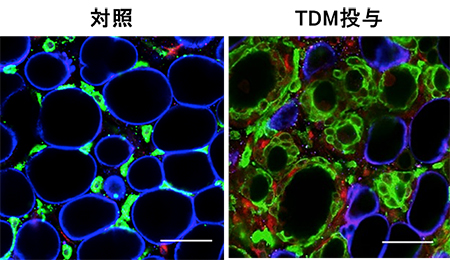
図7 Mincle活性化は脂肪組織のCLS形成と線維化を誘導する
非肥満の野生型マウスの脂肪組織に直接TDMを投与すると脂肪組織においてCLSが形成され、その周囲に線維化の成分であるコラーゲン沈着が増加した(図中の青:脂肪細胞、緑:マクロファージ、赤:コラーゲン)。
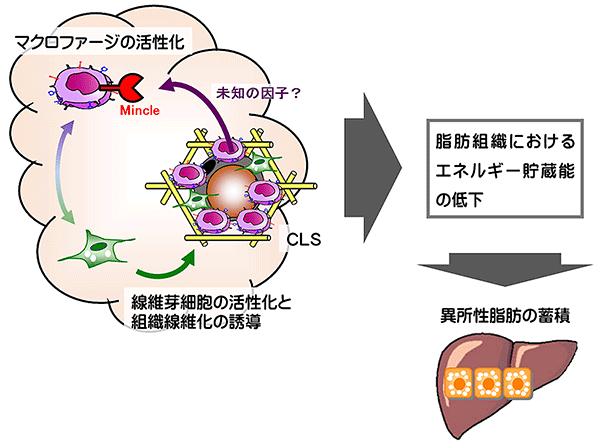
図8 脂肪組織線維化と異所性脂肪蓄積におけるMincleの意義
CLSの形成と慢性炎症の発生・悪化、線維化は、互いに影響を及ぼし合い、悪循環に陥って、その結果として脂肪組織におけるエネルギー貯蔵能が低下し、行き場を失った余剰の脂肪は肝臓などへの異所性脂肪蓄積につながると考えられる。今回、MincleがCLSで死んだ脂肪細胞を取り囲むマクロファージ上に発現することが明らかになった。生体中では、おそらく死んだ脂肪細胞から分泌されるMincle活性化分子(現在は未同定)がMincleを活性化させるものと想定される。そのため、Mincle活性化分子を同定し、この分子のMincleへの結合を阻止すれば、肝臓などにおける異所性脂肪蓄積が抑制され、糖代謝が良好に保つことができるかもしれない。
<用語解説>
- 注1) Mincle(Macrophage-inducible C-type lectin)
- 結核菌や真菌などの構成成分の分子パターンを認識する病原体センサーとして、生体の感染防御に中心的な役割を果たす。ほかの病原体センサーと異なり、死細胞を認識することが報告されている。
- 注2) 異所性脂肪
- 肝臓組織など、脂肪細胞を持たず正常であればごく少量にしか脂肪のない組織に蓄積する脂肪。皮下脂肪、内臓脂肪は脂肪細胞への蓄積であり、異所性脂肪と大きく異なることから「第三の脂肪」と呼ばれる場合もある。慢性的な過栄養にさらされると、脂肪細胞はサイズの増大(肥大化)や細胞数の増加(過形成)により脂肪蓄積量を増やすが、やがて脂肪細胞に蓄えきれない過剰な脂肪は血中を介して全身に作用し、非脂肪組織に異所性脂肪として蓄積し、はなはだしい場合は臓器の機能障害をもたらす。
- 注3) メタボリックシンドローム
- 内臓脂肪の蓄積に、糖代謝異常・血圧上昇・脂質代謝異常のいずれか2項目があてはまる場合にメタボリックシンドロームと診断される。生活習慣に基づいて発症するこれらの異常は、心臓病や脳卒中といった重大な疾患の発症リスクを高める。メタボリックシンドロームの段階で介入することにより、それらの重大な疾患の予防につながることから、最近では検診で早期に発見するよう厚生労働省なども呼びかけている。
URL:http://www.mhlw.go.jp/bunya/kenkou/metabo02/
- 注4) CLS(crown-like structure):王冠様構造
- 肥満の脂肪組織に特徴的な組織学的構造。CLS内では、細胞死に陥った脂肪細胞を免疫担当細胞のマクロファージが取り囲み、貪食・処理している。CLSは脂肪組織における炎症の起点となる。
- 注5) アディポサイトカイン
- 脂肪組織から産生・分泌される生理活性物質の総称。脂肪組織は、生体内で最大の内分泌臓器として、全身の恒常性維持に働く。過栄養により体脂肪量が増加すると、炎症性/インスリン抵抗性アディポサイトカインの産生が増加する一方、炎症抑制性/インスリン感受性アディポサイトカインの産生は減少する。このようなアディポサイトカインの産生異常や作用障害がメタボリックシンドロームの病態形成に中心的な役割を果たすことが知られている。
- 注6) M1マクロファージ
- 脂肪組織には、炎症促進性M1マクロファージと炎症抑制性M2マクロファージの少なくとも2種類のマクロファージが存在する。非肥満の脂肪組織ではM2マクロファージが局在するが、肥満の進展とともにM1マクロファージが脂肪組織に浸潤する。M1マクロファージは、CLSを形成して慢性炎症を惹起する。
- 注7) TDM(トレハロースジミコール酸:結核菌由来糖脂質)
- 結核菌の細胞壁を構成する物質。Mincleは、結核菌のTDMを認識することが証明されている。
- 注8) TGF-β(transforming growth factor-β)
- 活性化線維芽細胞やマクロファージから産生される物質。線維芽細胞を活性化して、細胞外マトリックスの産生を誘導する。代表的な線維化促進因子。
<論文タイトル>
“Macrophage-inducible C-type lectin underlies obesity-induced adipose tissue fibrosis”
(肥満脂肪組織の線維化におけるMincleの役割)
doi: 10.1038/ncomms5982
<お問い合わせ先>
<研究に関すること>
菅波 孝祥(スガナミ タカヨシ)
東京医科歯科大学 大学院医歯学総合研究科 臓器代謝ネットワーク講座 特任教授
〒113-8510 東京都文京区湯島1-5-45 東京医科歯科大学 M&Dタワー14階
Tel:03-5803-5216 Fax:03-5803-0172
E-mail:
小川 佳宏(オガワ ヨシヒロ)
東京医科歯科大学 大学院医歯学総合研究科 分子内分泌代謝学分野 教授
〒113-8510 東京都文京区湯島1-5-45 東京医科歯科大学 M&Dタワー14階
Tel:03-5803-5966 Fax:03-5803-0261
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ) 、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2067
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
東京医科歯科大学 広報部 広報課
〒113-8510 東京都文京区湯島1-5-45
Tel:03-5803-5833 Fax:03-5803-0272
E-mail: