慶應義塾大学 医学部 先端医科学研究所(遺伝子制御研究部門)の信末 博行(のぶすえ ひろゆき)特任助教、佐谷 秀行 教授らの研究チームは、日本大学 生物資源科学部 応用生物科学科の加野 浩一郎 教授らとの共同研究により、アクチン細胞骨格の動態注1)変化が脂肪細胞への分化を誘導するという現象の分子機構について解明しました。
本研究では、『細胞は、はじめに特異的な転写因子の発現によって機能的および形態的に分化する』というこれまでの細胞生物学の常識を覆し、細胞の形態変化によって、その細胞の運命が決まるという、一見逆とも思える現象のメカニズムの一端を明らかにしました。今後、癌細胞の基となる癌幹細胞の形態を変化させて、機能的な正常脂肪細胞へと導く(終末分化させる)という新たな癌治療戦略の開発に寄与する可能性が期待されます。
本研究成果は英国科学専門誌「Nature Communications」オンライン版に2014年2月26日(英国時間)に掲載されます。
1.研究の背景と目的
ヒトなどの多細胞生物の体は、形や働きが異なる様々な細胞によって形成されていますが、このように細胞が特定の形と働きを持つようになることを「分化」と呼びます。細胞分化は種々の転写因子の発現によって誘導されることが知られており、未分化な前駆細胞から成熟した脂肪細胞へと分化する時には、PPARγ注2)と呼ばれる転写因子がまず発現します。他方、細胞は分化に伴ってアクチンと呼ばれる細胞の骨組み(以下アクチン細胞骨格)を再構成し、それぞれの機能に特徴的な形態へと変化することが報告されてきました。しかしながら、アクチン細胞骨格の組み換えによる形態変化と分化という現象がどのような分子機構でつながっているのかは、ほぼ未解明のままでした。今回、信末特任助教らは、アクチン細胞骨格の動態変化が引き金になって脂肪分化が誘導されることを見出し、その分子メカニズムの解明に向けて本研究に取り組みました。
2.研究方法と研究成果の意義
まず、脂肪細胞のみならず、骨、軟骨、心筋などの細胞に分化する多能性を有する脱分化脂肪細胞株(DFAT)注3)を用いて、脂肪分化過程におけるアクチン細胞骨格の変化およびPPARγの発現を、時間を追って調べました(図1)。
その結果、DFATでは、分化誘導24時間以内にアクチンファイバーに脱重合(バラバラになること)が生じ、48時間後に脂肪分化のスイッチであるPPARγが発現したのち、脂肪細胞特有の表層アクチンが形成されることが分かりました。また、脂肪分化誘導したDFATにおいてアクチンファイバーの脱重合を阻害したところ、PPARγの発現および脂肪分化が有意に抑制されることが分かりました。
さらに、アクチンファイバーの形成を誘導するRhoAタンパク注4)の活性型変異体をDFATに強制発現させ、分化誘導すると、アクチンファイバーの形成が促進され、PPARγの発現が抑制されたものの、RhoAタンパクの下流で活性化されるRhoキナーゼ(ROCK)の阻害剤あるいはアクチン重合阻害剤で処理すると、アクチンファイバーは脱重合し、その結果PPARγの発現は回復することを見出しました(図2)。したがって、RhoA/ROCKシグナルの不活性化がアクチンファイバーの脱重合を促し、PPARγの発現および脂肪分化を直接制御することが明らかとなりました。
次に、アクチンファイバーの脱重合がどのようなメカニズムでPPARγの発現を直接制御するかを解明するために、脱重合によって生じた単量体G-アクチンと直接結合することで知られる転写活性化補助因子MKL1注5)に着目し、脂肪分化過程におけるG-アクチンとMKL1の細胞内での局在変化について調べました。その結果、分化前まではMKL1はそのほとんどが核内に局在しましたが、分化誘導に伴ってアクチンファイバーが脱重合し、細胞内でのG-アクチンレベルが増加するとともに、MKL1が細胞質内にとどまるようになりました。また、アクチン重合阻害剤であるLatrunclin A(LatA)注6)で処理することによって、細胞内のG-アクチンレベルが増加し、MKL1の核移行が阻害され、分化誘導剤を添加しなくてもPPARγの発現が誘導されることを見出しました(図3A)。さらに、G-アクチンと結合できない変異型MKL1(MKL1-N100)を強制発現させた細胞では、野生型MKL1と異なり、LatA処理によってG-アクチンレベルを増加させてもMKL1は核内に移行し、PPARγの発現を抑制することも分かりました(図3B、C)。これらのことから、アクチンファイバーの脱重合により増加したG-アクチンがMKL1の核移行を阻害することによって、PPARγの発現が直接誘導されることが明らかとなりました。つまりMKL1は核内ではPPARγの発現を抑える役割を持っていて、核から外に出ることでPPARγの発現が誘導されることになります。
さらに、DFATにおいてMKL1の発現をRNA干渉法(RNAi)注7)を用いて抑制すると、分化誘導剤がなくてもPPARγの発現が誘導され、脂肪細胞へと分化すること(図4A)、また、MKL1を発現抑制したDFATをマウス皮下に移植すると、体内においても脂肪細胞へと分化し、脂肪組織を形成することが分かりました(図4B)。さらに、元々脂肪分化能を持たないNIH3T3線維芽細胞株においてMKL1の発現を抑制すると、PPARγの発現が誘導されることを見出しました(図4C)。これらにより、アクチン細胞骨格により制御されるMKL1は脂肪分化のゲートキーパーとしての機能が明らかとなりました。
また、脂肪分化においてPPARγと逆相関して、MKL1の発現が減少することを見出しました。そこで、MKL1の発現制御にPPARγが関わっていると考え、PPARγの発現を抑制したところ、脂肪分化に伴うMKL1の発現減少は見られませんでした。一方、PPARγを強制発現させると、MKL1の発現が有意に減少しました。これらのことから、脂肪分化過程においてMKL1とPPARγは相互に抑制し合う機構があることが分かりました。
以上の結果から、線維状のアクチンがばらばらになることにより増加したG-アクチンがMKL1と結合して核への移行を阻害することによってPPARγが発現し始め、そして増加したPPARγによってMKL1の発現が抑えられることで脂肪細胞へと終末分化するという、巧妙なメカニズムが存在することが明らかとなりました(図5)。本研究は、細胞の「かたち」の変化が分化を直接制御する分子メカニズムを解明したものであり、「細胞分化は特異的な転写因子の発現によって直接制御される」という、これまでの常識を覆す新たな概念であると考えます。
3.今後の展開
今回の発見によって、アクチン細胞骨格の変化が脂肪細胞の分化を誘導するという分子現象が明らかになりましたが、他の細胞種への分化においても類似のメカニズムが働いている可能性があり、幹細胞から特定の細胞への分化をこれまでより容易に誘導できる手段の開発が見込まれます。また未分化な性質を持つ腫瘍細胞、つまり癌幹細胞を、アクチン動態を制御することで終末分化に導いて治療を行うことも理論的には可能であり、今後様々な応用が期待できます。
4.特記事項
本研究は、独立行政法人科学技術振興機構 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」における研究課題「人工癌幹細胞を用いた分化制御異常解析と癌創薬研究」(研究代表者:佐谷 秀行)、文部科学省 科学研究費助成事業 新学術領域研究「人工癌幹細胞を用いた治療抵抗性克服戦略の開発」(研究代表者:佐谷 秀行)、及び先端医療技術産業化研究事業の研究課題「細胞治療技術における細胞調整技術、評価技術及び作用機序等の基礎研究」(研究分担者:加野 浩一郎)における研究の一環として行われました。
5. 論文について
タイトル(和訳):Regulation of MKL1 via actin cytoskelton dynamics drives adipocyte differentiation.
(アクチン細胞骨格の動態によるMKL1の制御は脂肪分化をドライブする)
信末 博行、大西 伸幸、清水 孝恒、杉原 英志、沖嘉 尚、住川 優子、千代田 達幸、赤司 浩一、佐谷 秀行、加野 浩一郎
*2014年2月26日に英国科学専門誌「Nature Communications」オンライン版に掲載。
doi: 10.1038/ncomms4368
<参考図>
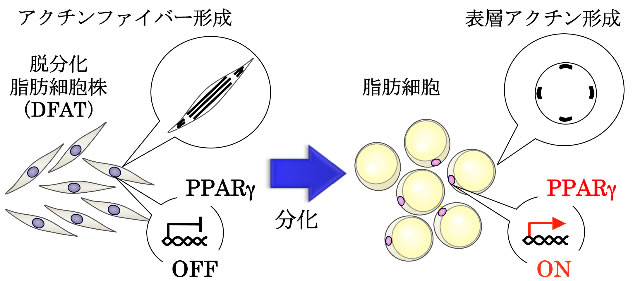
図1 脂肪細胞への分化とアクチン細胞骨格変化
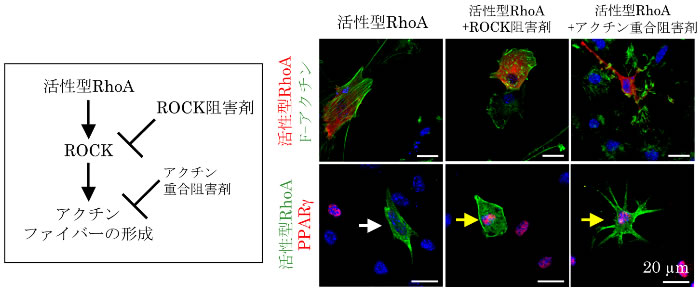
図2 RhoA/ROCK シグナルがPPARγの発現に及ぼす影響
活性型RhoA を強制発現させると、PPARγの発現は抑制されるが(白色矢印)、これにROCK 阻害剤あるいはアクチン重合阻害剤を加えることによってPPARγの発現は回復する(黄色矢印)。
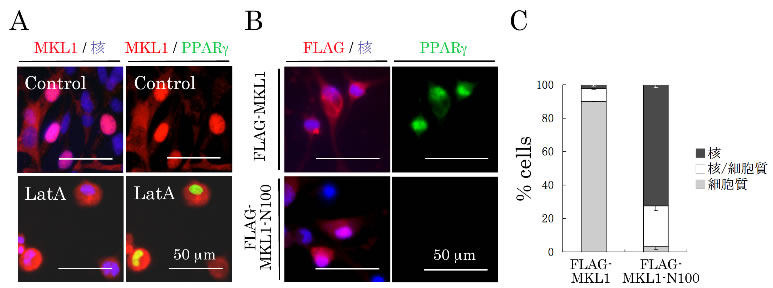
図3 G-アクチンとMKL1 の相互作用がPPARγの発現に及ぼす影響
アクチン重合阻害剤のLatA を添加すると、G-アクチンレベルが増加し、MKL1 の核移行が阻害され、分化誘導剤なしでもPPARγの発現が誘導される(A)。また、MKL1-N100 を強制発現すると、G-アクチンと結合できないために、LatA を添加してもMKL1 は核内に移行し、PPARγの発現が抑制される(B、C)。
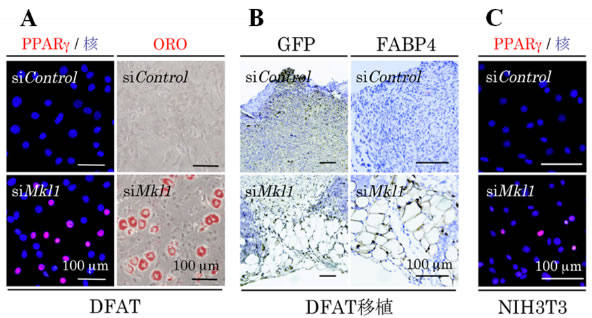
図4 MKL1 の発現抑制が体外および体内の脂肪分化に及ぼす影響
DFAT においてMKL1 の発現を抑制することによって、分化誘導剤がなくてもPPARγが発現し脂肪細胞への分化を誘導することが出来た(A)。さらに、MKL1 を抑制したDFAT をマウス皮下に移植すると、体内においても脂肪分化し、脂肪組織を形成した(B)。また元々脂肪分化能を持たないNIH3T3 線維芽細胞でさえ、MKL1 の抑制のみでPPARγの発現を誘導した(C)。
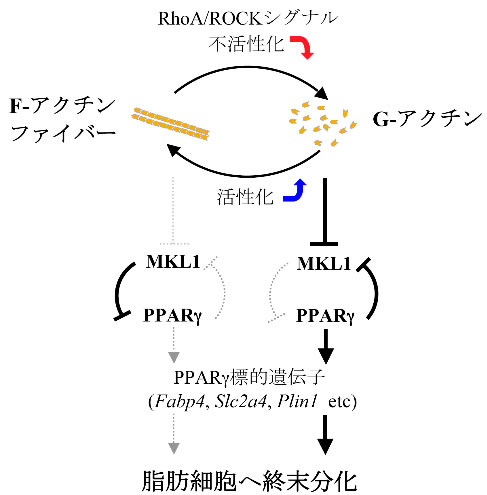
図5 アクチン動態によるMKL1 を介した脂肪分化制御メカニズム
RhoA/ROCK シグナルの不活性化によって増加したG-アクチンが、MKL1 と相互作用することによってMKL1 の核移行を阻害し、PPARγの発現を誘導する。PPARγはMKL1 の発現を抑制することによって、さらに活性化し、脂肪細胞へと終末分化する。
<用語解説>
- 注1)アクチン細胞骨格の動態
- 細胞形態は、主にアクチン細胞骨格によって決定される。アクチンは、1個のG-アクチンとそれが重合した線維状構造を持つF-アクチンの2 つの形状をとることが知られており、アクチン動態はG-アクチンとF-アクチンの間での状態転移によって調節される。
- 注2)PPARγ(ペルオキシソーム増殖因子活性化受容体γ)
- 受容体型核内転写因子。脂肪細胞の分化および発達に関わる遺伝子群の発現を直接制御することから、脂肪分化のマスターレギュレーターとして知られる。
- 注3)脱分化脂肪細胞株(DFAT)
- マウスの脂肪組織から単離した成熟脂肪細胞を天井培養という方法で体外培養することにより、脱分化が誘導され、生じてくる線維芽様の細胞。DFAT は多能性を有しており、脂肪細胞だけでなく、骨、軟骨、心筋など種々の細胞へと分化できる。
- 注4)RhoAタンパク
- 低分子量G タンパクの一種で、主に細胞骨格の制御に関わる。一般的に、RhoA は下流のエフェクターであるRho キナーゼ(ROCK)を介して、アクチンファイバーの形成を誘導することが知られている。
- 注5)MKL1
- 転写活性化補助因子であるMegakaryoblastic Leukemia 1(MKL1)は、G-アクチンが直接結合することによって核移行が阻害され、標的遺伝子のプロモーターに結合できないためにその転写活性化を阻害すること、一方、アクチン重合に伴ってG-アクチン量が減少すると、MKL1 はアクチンから解離したのち、核内に移行し、標的遺伝子の転写活性を促進することがこれまで知られていた。今回の発見はこの逆で、MKL1 が核内にいることで、PPARγの転写が抑制され、核外に移行することで転写が促進されるという所見が得られている。
- 注6)Latrunclin A(LatA)
- 単量体G-アクチンのATP 結合部位近傍に1:1で結合し、アクチン重合を阻害する。
- 注7)RNA干渉法(RNAi)
- 標的とするタンパク質のmRNA 発現を特異的に抑制する方法。
<本発表資料のお問い合わせ先>
慶應義塾大学 医学部 先端医科学研究所(遺伝子制御研究部門)
佐谷 秀行(さや ひでゆき)教授
TEL・FAX:03-5363-3982
E-mail:
ホームページ:http://genereg.jp/index.html
<JSTの事業に関すること>
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
川口 貴史(カワグチ タカフミ)
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
慶應義塾大学 信濃町キャンパス 総務課 冨田・齋藤
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3611 Fax:03-5363-3612
E-mail:
ホームページ:http://www.med.keio.ac.jp/
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432