ポイント
- 世界で約20億人が消化管寄生虫に感染しているが、感染防御に有効なワクチンはない。
- 「1度消化管寄生虫に感染すると、それ以降の感染では寄生虫を効率よく駆除できるようになる」という抵抗力獲得の仕組みを解明。
- 消化管寄生虫感染症に対する効果的ワクチン開発への応用に期待。
JST 課題達成型基礎研究の一環として、東京医科歯科大学 大学院医歯学総合研究科 免疫アレルギー学分野の烏山 一 教授らの研究グループは、生体が消化管寄生虫感染に対して抵抗力を獲得する仕組みを調べ、2度目以降の感染では白血球の一種である好塩基球が効率的寄生虫排除に重要な役割を果たしていることを発見しました。
いまだに世界人口の1/3近くが消化管寄生虫に感染し、健康上の大きな問題となっており、有効なワクチン開発が望まれています。
本研究グループは、消化管寄生虫の一種である鉤虫(こうちゅう)注1)の幼虫が皮膚から体内に侵入して肺を経由して消化管に到達して成虫になるという特徴に注目しました。2度目の寄生虫感染では皮膚から侵入した幼虫を好塩基球注2)が取り囲んで皮膚内に封じ込めることで、感染を肺や消化管まで拡大させない仕組みがあることを明らかにしました。これは従来知られていた消化管からの成虫排除とは異なる新たな生体防御メカニズムです。
本研究で発見された「消化管寄生虫に対する抵抗力獲得の新たな仕組み」を活用することで、効果的ワクチンの開発をはじめとする消化管寄生虫感染症に対する新たな治療法の開発が進むものと期待されます。
本研究は、東京慈恵会医科大学 熱帯医学・医動物学、東京医科歯科大学 国際環境寄生虫病学分野の協力を得て行われ、本研究成果は、2013年10月28日(米国東部時間)に米国科学誌「Journal of Experimental Medicine」のオンライン速報版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立病院機構 理事長) |
| 研究代表者 |
烏山 一(東京医科歯科大学 大学院医歯学総合研究科 教授) |
| 研究期間 |
平成21年10月~平成27年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、「好塩基球」ならびに「高IgE症候群」に関するアレルギー研究の成果を基盤として、従来とは異なるアプローチで、新たなアレルギー発症機構やその制御機構を分子レベル、細胞レベル、個体レベルで解明し、新規アレルギー治療法開発の基盤技術の確立を目指します。
<研究の背景と経緯>
近年、先進諸国において寄生虫感染症は激減しましたが、地球全体でみると熱帯・亜熱帯地域の開発途上国を中心として今も多くの人々が寄生虫感染症に罹患しています(図1)。とくに消化管寄生虫に感染している人の数は約20億と推定されており、マラリア患者数(約2億人)の10倍にもなります。小児期の消化管寄生虫感染は、貧血・栄養不良さらには知的・精神的発達障害をもたらし、感染者は就学や就労が困難になり、貧困から抜け出せない原因となっています。薬物による寄生虫駆除とともに、消化管寄生虫感染症を予防するための有効なワクチンの開発が必要とされています。
これまでの研究で、消化管寄生虫感染症を経験すると私たちの体に抵抗力ができて、2度目の感染では1度目に比べて効率よく寄生虫を排除できることが分かってきました。この抵抗力獲得の仕組みが分かれば、消化管寄生虫感染症に対する有効なワクチン開発に役立つものと期待されますが、その仕組みの詳細は不明のままでした。
<研究の内容>
本研究グループは、腸に寄生する鉤虫のマウス感染症モデルを用いて解析した結果、2度目の感染時には「お腹の虫を皮膚で退治する」という予想外の仕組みによって、生体が寄生虫感染の拡大を阻止していることを世界に先駆けて明らかにしました。
鉤虫は代表的な消化管寄生虫(図2)で、土の中で卵(図3左)から孵った幼虫(図3右)が裸足で歩いている人の皮膚から体内に侵入し、まず血管系を通って肺に移動し、さらに気道・食道を通過して最終目的地である小腸に到達した後に成虫となって産卵し、便とともに卵が体外に出て土中で孵化するという複雑な生活サイクルを繰り返します(図4)。鉤虫のマウス感染症モデルで調べたところ、2度目の感染では1度目の感染に比べて肺や小腸まで到達する幼虫の数が激減していること、それは幼虫が侵入した皮膚内に閉じ込められている(図5)ためであることが明らかとなりました。すなわち、これまで知られていた「腸に到達した寄生虫を腸から排出する」方法注3)とは別に、寄生虫を感染開始部位である皮膚に留めて肺や消化管への感染の拡大を防止するという新たな生体防御メカニズムが存在することが判明しました。
寄生虫が侵入した皮膚では、沢山の血球細胞が集まって来て寄生虫を取り囲んで皮膚内に留めていました(図5)。さらに詳しく調べたところ、血球細胞のなかでも好塩基球と呼ばれる細胞が重要で、寄生虫の侵入を察知するとインターロイキン4注4)というたんぱく質をたくさん分泌すること(図6)、さらにそのインターロイキン4がマクロファージ注5)と呼ばれる細胞に作用して寄生虫の動きを鈍らす物質(アルギナーゼ1)を分泌させることによって寄生虫を皮膚内に封じ込めること(図6)が明らかとなりました。生体内から好塩基球を取り除く操作をすると、寄生虫が皮膚に捕捉されずに多数の寄生虫が肺を通過するため、肺の出血や組織破壊がひどくなりました。つまり、好塩基球は寄生虫を皮膚に留めることで、寄生虫感染の拡大を防ぎ、寄生虫による組織破壊から肺を保護するという大切な役割を果たしていることが分かりました。
<今後の展開>
本研究で、これまで知られていた「1度消化管寄生虫感染症を経験すると私たちの体に抵抗力ができて、2度目の感染では1度目に比べて効率よく寄生虫を排除できる」という現象には、実は好塩基球の働きによって「お腹の虫を皮膚で退治する」という極めて巧妙な生体防御機構が働いていることが判明しました。
今回明らかにされた、消化管寄生虫の感染を好塩基球が中心となって皮膚で防御するという仕組みをうまく応用することで、消化管寄生虫に対する効果的なワクチンの開発が進むものと期待されます。また、寄生虫排除反応とアレルギー反応は表裏一体の関係にあることを鑑みると、好塩基球による寄生虫排除の仕組みをさらに詳しく調べることで、アレルギー疾患の発症メカニズムの解明が促進されることが期待されます。
<参考図>
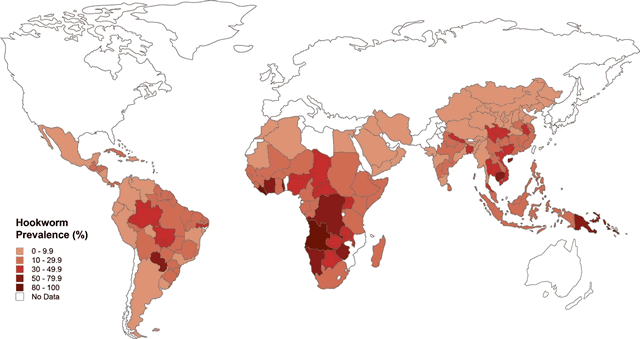
図1 鉤虫感染症の流行地域
(Hotez P. et al. (2005) Hookworm: “The Great Infection of Mankind”. PLoS Med 2(3): e67より引用)
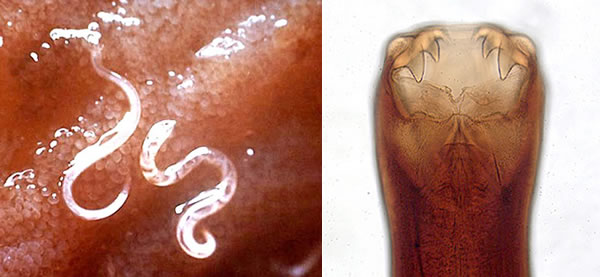
図2
- (左)小腸壁に食いついて吸血している2匹の鉤虫(成虫)
- (右)鉤虫の口部分
- (米国CDC Public Health Image Libraryより引用)
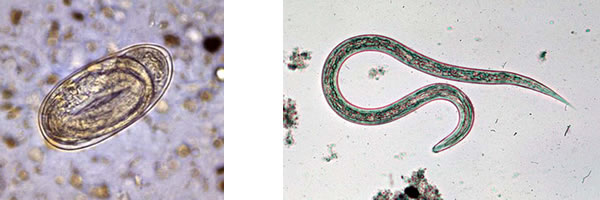
図3 (左)鉤虫の卵、(右)鉤虫の幼虫
(米国CDC Public Health Image Libraryより引用)
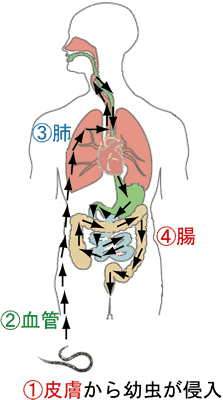
図4 宿主の体内を動き回る鉤虫
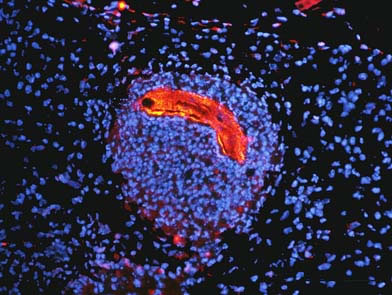
図5 皮膚の中に閉じ込められた鉤虫の幼虫(顕微鏡写真)
1度目の感染では、皮膚から侵入した幼虫は即座に血管に入って肺へと移動しますが、2度目の感染では、この写真にあるように幼虫(オレンジ色)が多数の血球細胞(青色)の塊のなかに閉じ込められ身動きが取れずに、肺や腸に到達することができません。血球細胞のなかで特に好塩基球が幼虫の捕捉に重要な働きをしていることが分かりました。
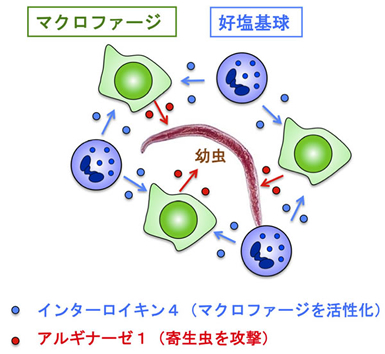
図6 消化管寄生虫に対する生体防御の新たな仕組み
2度目の感染では、幼虫が侵入してきた皮膚に好塩基球が集まって来て、幼虫を察知するとインターロイキン4を沢山分泌します。このインターロイキン4が幼虫の周囲に集まって来たマクロファージに作用すると、マクロファージはアルギナーゼ1を分泌して寄生虫の動きを鈍らせます。このようにして、幼虫を皮膚の中に閉じ込めることで寄生虫感染が肺や消化管まで拡大するのを食い止め、幼虫が肺を通過する際に生じる肺組織の破壊を防ぎます。
<用語解説>
- 注1)鉤虫(こうちゅう)
- 消化管に寄生する虫の代表で、人に感染するのは主としてズビニ鉤虫とアメリカ鉤虫の二種類です。熱帯地方を中心に約10億人が鉤虫に感染しています。ズビニ鉤虫は、主に中東、北アフリカ、インド、南ヨーロッパでみられ、一方アメリカ鉤虫は、アメリカ大陸、サハラ砂漠以南のアフリカ、東南アジア、中国、インドネシアなどでみられます(図1)。現在、日本国内で感染することはまれですが、戦前までは日本でも多数の症例がみられました。メスの成虫は体長10-12mm、体幅0.6-0.7mmで、オスの成虫はそれよりも少し小型です(図2)。メスの成虫は毎日何千個もの卵(図3左)を産むため、大量の虫卵が糞便とともに体外に排出されます。外界に出た虫卵は土中で孵化し、2回脱皮したのち感染幼虫(図3右)となります。幼虫は人の足や手の皮膚に穴を開けて体内に侵入したのち、血管系を通って肺に到達します(図4)。さらに肺胞の壁を突き破って気管に入り、咽頭、食道、胃を経て最終目的地である小腸上部に到達して寄生し、腸管壁にとりついて吸血をおこないます(図2)。この鉤虫の体内移動に呼応して、幼虫が侵入する際の皮膚のかゆみ、幼虫が肺を通過する際の胸痛・咳・喘鳴(ゼーゼー、ヒューヒュー)・喀血、消化管内の成虫がひきおこす腹痛・下痢・食欲不振・体重減少・貧血などがみられます。
- 注2)好塩基球
- 血中を流れる白血球の約0.5%を占めるに過ぎない極少血球細胞。長年その存在意義が不明でしたが、最近の研究によりアレルギーの発症や寄生虫に対する生体防御に重要な働きをしていることが次第に分かってきました。
- 注3)「腸に到達した寄生虫を腸から排出する」方法
- 腸管の粘膜細胞がたくさんの粘液を分泌することによって、寄生虫はちょうどすべり台に乗った感じで腸管をすべりおちていって便とともに体外に排出されます。
- 注4)インターロイキン4
- サイトカインと総称されるたんぱく質の1つで、アレルギー反応や寄生虫感染防御に関与する2型免疫反応に関与します。主に、T細胞、好塩基球、マスト細胞、NKT細胞によって産生されます。
- 注5)マクロファージ
- 白血球の一種で、異物や死細胞などを取り込んで処理する掃除屋の役割を担っています。大食細胞とも呼ばれます。1型と2型に大別され、前者は結核など細胞内寄生細菌の排除に、後者は寄生虫の排除や組織修復に重要な働きをしているといわれています。
<論文タイトル>
“The skin is an important bulwark of acquired immunity against intestinal helminths”
(皮膚は、消化管寄生虫に対抗する獲得免疫を発揮するための重要な砦である)
doi: 10.1084/jem.20130761
<お問い合わせ先>
<研究に関すること>
烏山 一(カラスヤマ ハジメ)
東京医科歯科大学 大学院医歯学総合研究科 免疫アレルギー学分野 教授
〒113-8519 東京都文京区湯島1-5-45
Tel:03-5803-5162 Fax:03-3814-7172
E-mail:
<JSTの事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
東京医科歯科大学 広報部 広報課
〒113-8519 東京都文京区湯島1-5-45
Tel:03-5803-5833 Fax:03-5803-0272
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432