ポイント
- 膜たんぱく質を人工的に「進化(改変・改良)」させることは非常に困難であった。
- α-ヘモリシンの機能を約30倍高め、人工的に「進化」させることに成功。
- バイオ医薬品スクリーニング、バイオセンサー素子の創出などへの波及効果が期待。
JST 課題達成型基礎研究の一環として、大阪大学 大学院情報科学研究科 四方 哲也 教授、工学研究科 松浦 友亮 准教授の研究チームは、人工細胞注1)を用いて膜たんぱく質を実験室で「進化」させることに成功しました。
変異と選択を繰り返すというダーウィン進化を実験室で再現し、生体高分子であるたんぱく質の性質を改変・改良する方法は、1990年代に開発されて以来、医薬品の開発などに世界中で大きな成果を挙げてきています。しかし、膜たんぱく質は一般に不溶性であり、かつ異種細胞での発現が困難であるという性質を持つため、生理学的・産業的に重要であるにも関わらず、人工的な改変はほとんどされていませんでした。
研究チームは、たんぱく質合成に必要な物質を内封した細胞サイズの人工脂質二重膜小胞(リポソーム)内で、遺伝子から膜たんぱく質を合成することにより、その人工細胞膜上に膜たんぱく質が組み込まれることを見いだしました。さらに、人工細胞の外部から内部へ物質が取り込まれるという膜たんぱく質の活性も確認できました。
次に、膜たんぱく質の遺伝子に変異を導入した集団の中から、より機能の高い膜たんぱく質をコードする遺伝子を選択してくることに成功しました。この手法を用いることにより、膜たんぱく質の1つであるα-ヘモリシンの機能を野生型よりも約30倍も人工的に「進化」させることに成功しました。この高機能α-ヘモリシンは、これまでに開発されているα-ヘモリシンを利用したDNA配列解析装置の高性能化へつながることが期待されます。
さらに、「リポソームディスプレイ法(liposome display)」と名付けたこの手法は、さまざまな膜たんぱく質に適用可能です。ある特定の物質を高い選択性で透過させる膜たんぱく質を用いた高性能バイオセンサーの創出や、膜たんぱく質に強く結合することによりその機能を阻害する新たな薬の発見など、多方面への波及効果が期待されます。
本研究成果は、米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版で2013年9月30日(米国東部時間)の週に掲載されます。
本成果は、以下の事業・プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
| 研究プロジェクト |
「四方動的微小反応場プロジェクト」 |
| 研究総括 |
四方 哲也(大阪大学 大学院情報科学研究科 教授) |
| 研究期間 |
平成21年10月~平成27年3月 |
上記研究課題では、細胞の特性を持つ動的微小反応場を実験的に創造することを通じて、生物学、化学、物理学、工学の融合により新領域を切り開く人材の育成を目指します。
<研究の背景と経緯>
遺伝子操作などのバイオ技術が開発された当初、たんぱく質のある特定の部位に変異を導入すること(部位特異的変異導入法)により、自由にその機能を改変することや活性を強化できるようになるとの期待が高まりました。ところが現実には、たんぱく質内部の予想できない複雑な相互作用により、ある特定の部位への変異導入がたんぱく質のほかの部位へ影響を与えることになってしまい、目的とする機能への改変や活性の強化ができないばかりか、活性を大きく損なうことが少なくありませんでした。
そのような状況の中、1990年代になり、部位特異的変異導入法とは、全く異なる手法である進化分子工学的手法が考案されました。進化分子工学的手法は、ダーウィン進化を実験室で模倣することにより、変異と選択のステップを繰り返し行うことで生体高分子の性質を改変・改良していくという方法です。この手法は、遺伝子へのランダムな変異導入によって作られた10万から100万種類のたんぱく質を用意し、それぞれの性質に沿った選択を行うことにより、目的の性質を持つたんぱく質を得ることができます。こうして得られたたんぱく質に対して、さらに変異と選択を適用することにより、その目的に沿った性質を強化していくことができます。
この進化分子工学的手法は、10万から100万種類の翻訳されたたんぱく質とその遺伝子をそれぞれ個別に対応させる必要があります。このたんぱく質とその遺伝子を個別に対応させるための方法として、ファージと呼ばれる細菌に感染するウイルスを用いるファージディスプレイ法注2)やたんぱく質の翻訳を完全に終了させずリボソーム(ribosome)・たんぱく質・メッセンジャーRNAの複合体を用いるリボソームディスプレイ法(ribosome display)注3)などの手法が開発されてきました。
このような進化分子工学的手法は、可溶性たんぱく質に多く適用され、産業上有用なたんぱく質・酵素の創出などに貢献するとともに、たんぱく質の機能発現メカニズムの解明にも寄与してきました。
一方で、細胞がコードする遺伝子の20-30%は膜たんぱく質になります。膜たんぱく質は脂質二重膜である細胞膜表面に付着したり、細胞膜自体を貫通したりしている脂質二重膜と相互作用するたんぱく質です。
これらの膜たんぱく質には重要な働きを持つものが多数存在します。細胞外の物質が細胞表面に露出した膜たんぱく質に結合することにより、外部からのシグナルを細胞内部に伝達したり、細胞外のある特定の物質だけを内部に特異的に取り込みます。そして、インフルエンザやHIVなどウイルスの多くは、細胞表面のある特定の膜たんぱく質に吸着することにより細胞に感染を開始することなどから、製剤のターゲット分子の50%以上は膜たんぱく質であると言われています。しかし、ファージディスプレイ法やリボソームディスプレイ法では、異種たんぱく質の発現量が少ない、膜たんぱく質の発現によってファージが増殖できなくなる、膜たんぱく質は脂質二重膜に組み込まれていない状態では不安定で脂質二重膜に組み込まれていない状態での選択操作はできない、などの問題点がありました。そのため、これまでに膜たんぱく質は、進化分子工学の標的たんぱく質としてほとんど扱われてきませんでした。
<研究の内容>
膜たんぱく質を実験室で進化させるためには、まず合成する必要があります。一方、膜たんぱく質は、細胞内での発現量が少なく疎水領域が多いため、調製中に凝集体を形成しやすい、大量発現によって細胞毒性を示す、膜組成の違いによって異種発現たんぱく質が機能しないなど、試料調製を困難にする性質を持っています。
そこで研究チームでは、細胞サイズの人工脂質膜小胞リポソーム(liposome)の内部にたんぱく質合成に必要なものを全て埋め込んだ人工細胞を用いて、膜たんぱく質を合成しました。この人工細胞内で、遺伝子から膜たんぱく質をわずか数時間で合成することに成功しました。
次に、合成された膜たんぱく質は人工脂質膜に組み込まれることで、初めてその機能を発揮します。研究チームは人工脂質および人工細胞内の分子を工夫し、膜たんぱく質が脂質膜に組み込まれ、機能を発揮する条件を見いだしました。
さらに、遺伝子に人工的に変異を導入し、100万種類の多様な遺伝子の集団を作成しました。膜たんぱく質の機能を進化させるためには、膜たんぱく質の遺伝子の集団から、機能の高い膜たんぱく質の遺伝子を選択する技術が必要です。研究チームでは、機能の高い膜たんぱく質を発現した人工細胞は、より強い蛍光強度を示す実験系を確立し、蛍光セルソーターを用いて選択してくることに成功しました。この人工細胞を使って膜たんぱく質を実験室で進化させる技術を「リポソームディスプレイ法(liposome display)」と名付けました。
リポソームディスプレイ法の有効性を示すために、生体膜に穴を開ける膜たんぱく質「α-ヘモリシン(図1)」の実験室進化を行いました。まずは、リポソーム内部にα-ヘモリシンの遺伝子とたんぱく質合成に必要な全因子を入れ、人工細胞を構築します。この時、遺伝子の濃度を十分に低くすることで人工細胞のほとんどが遺伝子を含まず、一部の人工細胞のみが1つの遺伝子を含むようにします。2つ以上の遺伝子が入ってしまうと、高活性の遺伝子と低活性の遺伝子が混ざり合って、高活性の遺伝子活性が打ち消されてしまうからです。
このようにして作成した人工細胞を37度で反応させ、遺伝子からたんぱく質を合成すると、α-ヘモリシンの活性に応じて、脂質膜に穴が形成されます。次に、外部から蛍光物質を与えるとα-ヘモリシンの活性に応じて蛍光物質の取り込み量が増えるシステムを構築しました。蛍光物質は、α-ヘモリシンの穴を通してのみ人工細胞の内部に入り、穴の数が多い人工細胞ほどより多くの蛍光物質を取り込みます。蛍光物質は人工細胞の内部で巨大分子と共有結合するようにシステムを構築したので蛍光物質は人工細胞の内部には流入しても、外部へ漏れ出しません。これにより、蛍光物質が一方通行で時間とともに蓄積していくため、人工細胞の蛍光を高感度に検出できます。
最も多くの蛍光物質を取り込んだ人工細胞を、蛍光セルソーターで選択・分取しました。分取された人工細胞からは高機能型の遺伝子が得られ、その遺伝子を用いて再度人工細胞を作製して同様の作業を繰り返します。これらの作業を20回繰り返した結果、野生型よりも約30倍も脂質膜に穴を開ける能力の高い変異体の取得に成功しました。
この方法は、α-ヘモリシン以外の複数の膜たんぱく質でも合成可能で、それらのたんぱく質が人工脂質膜に組み込まれることも示しており、このことはリポソームディスプレイ法がさまざまな膜たんぱく質の実験室進化に利用できる可能性を示唆しています。
<今後の展開>
進化分子工学を用いた可溶性たんぱく質の機能改変のため、1990年代からさまざまなディスプレイ技術が開発されてきました。現在、これらの技術は世界中で利用されバイオ医薬品の開発など、学術のみならず産業界においても大きな成果を上げています。
本研究成果は、従来のディスプレイ技術では扱えなかった膜たんぱく質を対象とするディスプレイ法が日本から世界へ発信されることになります。リポソームディスプレイによりさまざまな機能を改変、もしくはより高機能化した「便利な膜たんぱく質」を構築することが可能になるため、高性能バイオセンサーの開発などにも寄与すると思われます。ほかにも膜たんぱく質に強く結合することによりその機能を阻害する新たな薬の発見など、多方面への波及効果が期待されます。研究グループではすでにリポソームディスプレイ法に関する特許出願を済ませており、今後、産業界と連携して膜たんぱく質の産業利用など多方面への展開が期待されます。
<参考図>
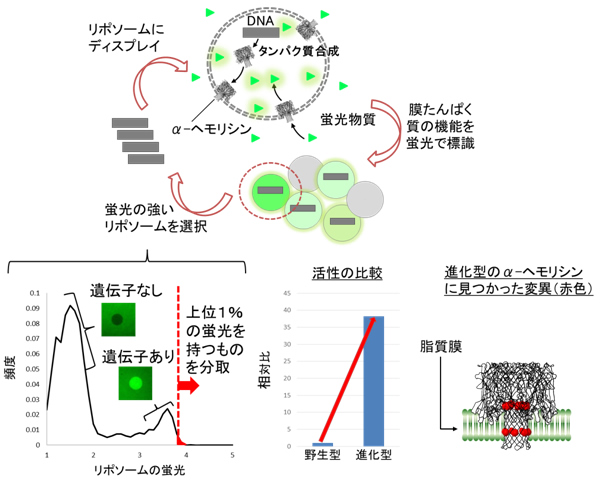
図1 リポソームディスプレイによるα-ヘモリシンの「進化」
α-ヘモリシンの遺伝子に人工的に変異を導入します。この遺伝子をリポソーム内部に封入すると、α-ヘモリシンのたんぱく質が合成されます。合成されたたんぱく質はリポソームの脂質膜に刺さり、小さな穴を開けます。穴の数が多い程、より多くの蛍光物質が流入します。より多くの蛍光物質を流入させたリポソームを分取し、内部のDNAを取り出して同様の作業を繰り返すと、穴を形成しやすい遺伝子が得られます。左下のグラフは実際に蛍光輝度と頻度を表したヒストグラムです。遺伝子が入っていないリポソームは暗く、遺伝子が入っているリポソームは明るいことが分かります。明るいリポソームの中でも特に蛍光輝度が高いリポソームを分取します。中央下のグラフは本研究によって得られた「進化」型と野生型の膜たんぱく質活性を測定した結果です。右下の図は進化型のα-ヘモリシンを解析した結果、変異が見つかった部位を赤色で示しています。ちょうど脂質膜に組み込まれる部分に変異が集中している様子が見られます。
<用語解説>
- 注1) 人工細胞
- はっきりした定義は成されていないが、一般的には細胞の機能の一部を人工的に再構成した細胞状の構造を人工細胞と呼ぶことが多い。本研究の人工細胞は、細胞の機能のうち、たんぱく質合成に必要なものを全て持ち、その系による遺伝子翻訳、脂質二重膜による微小区画構造が人工的に再構成されている。
- 注2) ファージディスプレイ法
- ランダムに変異を導入した遺伝子をファージ内でたんぱく質に翻訳させ、この際、翻訳されたたんぱく質は、ファージ表面に露出するように設計を行っている。ファージ1つに対して1種類の遺伝子が導入されるように調整することにより、1種類のたんぱく質をその表面に露出した10万から100万種類のファージの集団が得られるようにする。このファージの集団に対して、選択操作を行うことにより、目的の性質を持つたんぱく質が得られるとともに、その目的の性質を持つたんぱく質の遺伝子が得られることになる。このような変異・選択のサイクルを繰り返すことにより、目的に応じて「進化」させたたんぱく質あるいは遺伝子を得るための手法。
- 注3) リボソームディスプレイ法(ribosome display)
- たんぱく質翻訳に必要なものを細胞から取り出し、実験室でRNAを加えるだけでたんぱく質が翻訳されるように調製した無細胞翻訳系というものを用いる方法。末端に翻訳が停止するような特殊な配列を付加した10万から100万種類の遺伝子を無細胞翻訳系で翻訳を行うことにより、1種類のたんぱく質が固定された10万から100万種類のリボソーム・たんぱく質・メッセンジャーRNAの複合体を得る。この複合体の集団に対して選択操作を行い、たんぱく質の性質に応じての選択操作により、目的の性質を持つたんぱく質を得るとともに、その目的の性質を持つたんぱく質の遺伝子が得られることになる。このような変異・選択のサイクルを繰り返すことにより、目的に応じて「進化」させたたんぱく質あるいは遺伝子を得るための手法。
<論文タイトル>
“In vitro evolution of α-hemolysin using a liposome display”
(リポソームディスプレイ法を用いたαヘモリシンの実験室内進化)
doi: 10.1073/pnas.1314585110
<お問い合わせ先>
<研究に関すること>
四方 哲也(ヨモ テツヤ)
大阪大学 大学院情報科学研究科 教授
〒565-0871 大阪府吹田市山田丘1-5
Tel:06-6879-4151 Fax:06-6879-7433
E-mail:
<JSTの事業に関すること>
中村 幹(ナカムラ ツヨシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: