ポイント
- 認知症の神経細胞死に直結するタウタンパク質(以下、タウ)の蓄積を生体で可視化するポジトロン断層撮影(以下、PET)用薬剤PBB3を開発し、アルツハイマー病およびアルツハイマー病以外の認知症におけるタウ病変の生体画像化を世界で初めて実現した。
- このPET薬剤で描出されたタウ病変の広がりは、神経細胞死の範囲と認知症の重症度を反映することが示され、認知症の診断と治療薬開発の促進が期待される。
放射線医学総合研究所(以下、放医研) 分子イメージング研究センター 分子神経イメージング研究プログラム(須原 哲也 プログラムリーダー) 脳分子動態チームの樋口 真人 チームリーダーらは、世界で初めて脳内でのタウ注1)の蓄積をPET注2)により画像化することに成功し、タウの蓄積とアルツハイマー病の重症度の関連性を示唆する成果を得ました。さらに、アルツハイマー病以外の認知症でのタウの画像化においても有効であるとの成果を得ることができ、 多様な認知症についての発症メカニズムの解明や、症状からの診断が困難である発症初期の診断、重症度の客観的な診断、認知症治療薬の開発促進が期待されます。
近年、認知症患者の増加が社会問題となっていますが、発症原因は不明な点も多く、効果的な治療法は確立されていません。国内の全認知症患者の半数にのぼるとされるアルツハイマー病患者の脳内では、アミロイドベータ(以下、Aβ)注3)やタウの蓄積に伴い神経細胞が死ぬことで、物忘れなどの症状が発現していきます。アルツハイマー病の確定診断は脳内において、これら異常タンパク質の蓄積を確認することが必要ですが、これまでは患者の死後に脳切片を染色して顕微鏡で見ることで、確認できるものでした。その状況を変えたのがPETによる生体内でのAβの画像化技術ですが、タウの画像化は未開発でした。
今回、放医研は、タウの蓄積を画像化するPET薬剤(PBB3)注4)を開発し、認知症モデルマウス注5)とヒトで脳内タウ病変を明瞭に画像化しました。アルツハイマー病患者では、疾患の進行に伴うタウ蓄積部位の拡大が明らかに確認でき、皮質基底核変性症注6)という異なる種類の認知症のタウ病変も画像化できました。
本研究の成果により、発症初期からの認知症の鑑別診断、および疾患の進行度の客観的評価が可能になりました。これまでは、神経細胞死に密接に関わるのは神経の外に蓄積するAβであると考えられていましたが、最近の研究により、より影響を与えているのは神経の中に蓄積するタウであるという考えが強くなっていることから、 PBB3はモデルマウスを活用したタウ蓄積抑制治療薬の評価や、その後のヒトでの新規治療薬の評価など、認知症の根本治療法の開発への貢献も期待されます。
本研究は、文部科学省委託事業「分子イメージング研究戦略推進プログラム」、科学技術振興機構(JST) 戦略的創造研究推進事業(CREST)などの支援を受けて実施されたもので、米国科学誌「Neuron」のオンライン版に9月19日(日本時間)に掲載されます。
<研究の背景と目的>
厚生労働省 研究班の調査によると、国内の認知症患者は2012年の時点で約462万人にのぼることが判明しています。このうち、約半数はアルツハイマー病患者であると考えられています。アルツハイマー病患者数はこの数年でも急増していますが、人口の高齢化が進むにつれて、今後ますます増加すると予想されます。
アルツハイマー病患者の脳内にはアミロイドベータ(以下、Aβ)とタウと呼ばれるタンパク質が蓄積し(図1上)、これに伴って神経細胞が死んで脱落することから脳が萎縮し(図1下)、物忘れなどの症状が発現してきます。こうした異常タンパク質蓄積は、存命している状態で検出することは難しく、これまで患者が亡くなってから脳を解剖して調べていました。
近年、病的な蓄積をするタンパク質に特異的に結合する薬剤を開発し、これを用いることで生きている患者の脳における病変を画像化する研究が進められています。薬剤を特定の放射性同位元素で標識してこれを投与した患者のPET撮影を行い、薬剤から出てくる放射線のデータを解析することで、タンパク質の異常な蓄積を画像化することが可能になります。
最近の研究から、神経細胞死に密接に関わるのは神経の外に蓄積するAβではなく、神経の中に蓄積するタウであると考えられていることから、放医研では、タウ病変を画像化することでAβの画像化では十分評価できなかったアルツハイマー病の病勢評価や根本的治療法の開発が可能になると考え、生体脳でタウ病変に結合するPET薬剤の開発に着手しました。
<研究手法と結果>
タウ病変を画像化することを目的としたPET薬剤の開発には、世界的に数多くの研究グループが取り組んできました。しかし、実際の脳組織や生体モデルを用いずに試験管内の反応性に基づいて薬剤を選び出しても、有望な薬剤は得られてきませんでした。放医研では脳組織スライスにさまざまな構造を持った薬剤を直接反応させることによって、脳内タウ病変に結合する薬剤を探索し、その結果からタウ凝集体の分子構造に至適な分子長があることを見出して新たな化合物群を作製しました。この化合物群は、アルツハイマー病に限らず、これ以外の認知症やタウを過剰発現させた認知症モデルマウス(タウ病変モデルマウス)のタウ病変にも結合することが分かりました。
次に、化合物群の中でタウ病変に選択的に結合する薬剤3種類を選び出し、放射性同位元素である11Cで標識して、タウ病変モデルマウスに投与しPET撮影を行ったところ、PBB3という薬剤の標識体([11C]PBB3)が最も高いコントラストでタウ病変を検出できることが判明しました(図2)。
基礎研究で[11C]PBB3の有用性が確かめられたことより、放医研の研究倫理審査委員会より承認を得た上で、アルツハイマー病患者3名と、認知機能が正常な高齢者3名を対象とした探索的な臨床研究を実施しました。この臨床研究では同一の被験者において、[11C]PBB3を投与した際のPET画像を、Aβ病変を画像化する[11C]PIB注7)を投与した際のPET画像と比較しました。その結果、[11C]PBB3はアルツハイマー病患者脳の海馬という領域に強く集積しましたが、[11C]PIBは海馬以外の領域(大脳皮質など)に強く集積しました(図3)。これまで多くのグループによる死後脳の研究で、アルツハイマー病患者の海馬ではタウ病変が大量に蓄積し、Aβ病変は大脳皮質ほど多くないことが明らかになっていることから、[11C]PBB3の海馬への集積はこの薬剤のタウ病変への結合を示す証拠と考えられます。
さらに[11C]PBB3の集積部位は、初期には海馬付近で認められ、アルツハイマー病を発症して重症化するに従い、大脳辺縁系全体、さらに、大脳皮質の広い領域へと拡大することが分かりました(図4)。この所見は脳を解剖して調べることで推測されていたタウ病変部位拡大の推移とよく一致していました。これに対して、[11C]PIBの集積部位はアルツハイマー病の発症後は、極めて重度の場合を除き変化せず、疾患の重症度を反映してはいませんでした。したがって、[11C]PBB3を用いたPET検査により、タウ蓄積部位の広がりに基づいて、アルツハイマー病の発症や進行を客観的に評価することが可能になりました。
また、[11C]PBB3はアルツハイマー病以外の認知症で蓄積するタウ病変にも結合することが基礎研究で示唆されていましたが、実際に非アルツハイマー型認知症の患者でもタウ蓄積を画像化することに成功しました。皮質基底核変性症という、運動障害と認知機能障害を主症状とする疾患の患者に[11C]PBB3を投与してPETを実施したところ、大脳皮質に加えて、基底核、脳幹と呼ばれる脳の深部においても薬剤の顕著な集積が認められました(図5)。これらの領域は皮質基底核変性症でタウが蓄積すると考えられている部位に一致していました。また、[11C]PIBはこの患者で集積が見られず、Aβは蓄積していないことが確かめられました。これらの結果に基づき、Aβ蓄積が起こらない非アルツハイマー型の認知症において、[11C]PBB3が鑑別診断に有力な手掛かりをもたらすことが明らかになりました。
<本研究成果と今後の展望>
今回開発した新しい種類のPET薬剤PBB3により、アルツハイマー病の脳内のタウ蓄積を明瞭に画像化することに成功しました。また、PBB3はアルツハイマー病だけでなく、ほかの認知症で形成されるタウ病変も描出し、神経細胞の脱落を鋭敏に検出できる手段として認知症診断に広く応用できることも明らかになりました。また、タウ病変は脳内の狭い領域から始まって広がっていくことが分かってきたことから、物忘れや感情の変化といった認知症の症状が脳内のどのような神経回路の異常で起こってくるのか、さらにどのような条件で症状の進展が止められるかといった研究に極めて重要な手がかりを与えてくれると期待されます。
また、タウ病変が神経細胞死を反映していることから、このような治療薬は認知症の症状が明確になった段階でもそれ以上の神経細胞死を防ぐことにより、認知症の症状の重症化を防ぎ介護の負担を大幅に減少できる可能性があります。治療薬を臨床試験(治験)で評価する際に、モデルマウスとヒトで同じPET薬剤を利用できることから、治療薬開発の基礎と臨床を切れ目なくつなぐことが可能になります。認知症治療の切り札となりうる抗タウ療法の実現へ向けて、本研究の成果が大きく貢献することが期待されます。
一方、近年米国ではアメリカンフットボールの選手や、戦争で頭に外傷を受けた軍人に精神障害が起こり、その死後、脳解析から外傷後の脳にタウの異常蓄積があることが注目されています。今後は、認知症以外における、外傷後の精神障害などの機序が明らかではなかった脳の機能障害の研究にもタウ病変イメージングが応用されていくことが期待されます。
なお、本研究の成果の一部は、文部科学省 委託事業「分子イメージング研究戦略推進プログラム」、独立行政法人 科学技術振興機構 戦略的創造研究推進事業 CREST(課題名「iPS細胞を駆使した神経変性疾患病因機構の解明と個別化予防医療開発」)、文部科学省 科学研究費補助金 新学術領域研究(課題名「毒性伝達機構の分子イメージングを基軸とした神経変性疾患研究」)の一環として行われた研究により得られたものです。
<参考図>
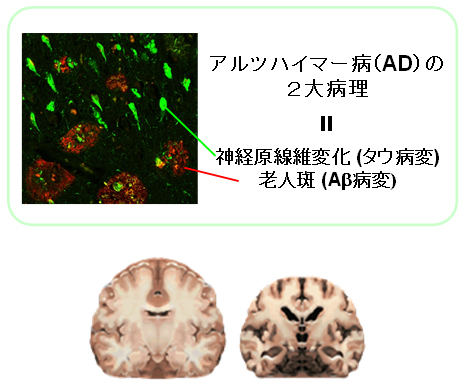
図1 アルツハイマー病における脳の変化
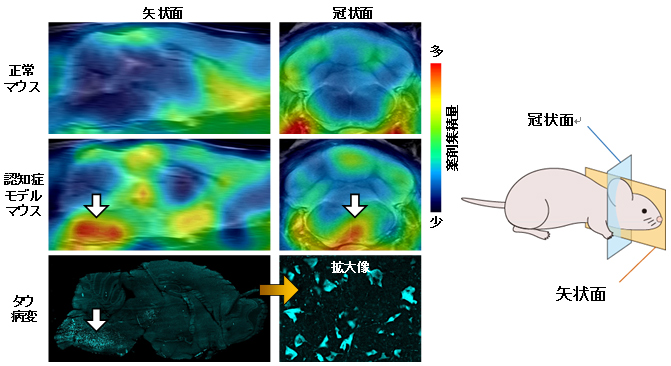
図2 [11C]PBB3投与後の認知症モデルマウス脳PET画像
正常マウス(上段)では脳内の薬剤集積量はわずかだが、タウを過剰に発現させたモデルマウス(中段)では薬剤集積が見られ、特に脳幹と呼ばれる脳の深部領域(白矢印)で強い集積が認められた。このモデルマウスの脳をスキャン後に摘出し、タウ病変の分布を蛍光色素で調べた結果(下段)、PBB3の強い集積が見られた脳幹に多数のタウ病変が見出された。したがって、モデルマウスのPET画像はタウの蓄積を反映することが分かった。
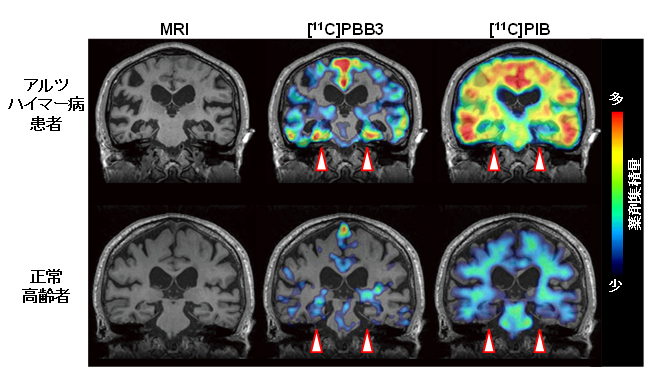
図3 臨床研究で得られたMRIおよびPET画像
同じ被験者で[11C]PBB3(タウ病変を検出)と[11C]PIB(Aβ病変を検出)の脳内集積を比較した。アルツハイマー病患者(上段)では、正常高齢者(下段)に比べて海馬を含む領域(矢頭)で[11C]PBB3の集積が顕著に見られた。一方、[11C]PIBは海馬領域への集積はあまり見られず、Aβが多量に蓄積する大脳皮質で集積が認められた。海馬領域ではタウは高度に蓄積するが、Aβ蓄積は比較的少ないことより、[11C]PBB3の脳内集積はアルツハイマー病患者でもタウ蓄積を反映すると考えられる。MRI画像では、アルツハイマー病患者の海馬領域における萎縮が顕著であり、タウ蓄積によって神経細胞死が起こったことが示唆される。
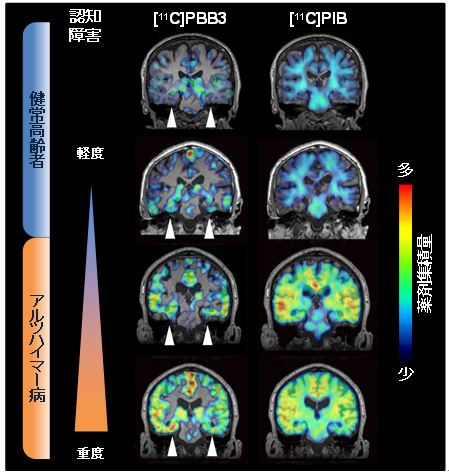
図4 アルツハイマー病の発症と進行に伴うPET薬剤集積量の変化
[11C]PBB3の脳内集積は、海馬(矢頭)を含む領域で増加が始まり、アルツハイマー病の発症と進行に伴って広範な領域で増加をきたすことが明らかになった。これに対して、[11C]PIBの脳内集積はアルツハイマー病発症時には広い範囲で増加を認め、病気が進行しても、極めて重度の場合を除き集積量や分布にほとんど変化が見られなかった。以上より、[11C]PBB3で検出されるタウ蓄積の量と分布は、アルツハイマー病の発症と進行に対する客観的な指標となることが示された。
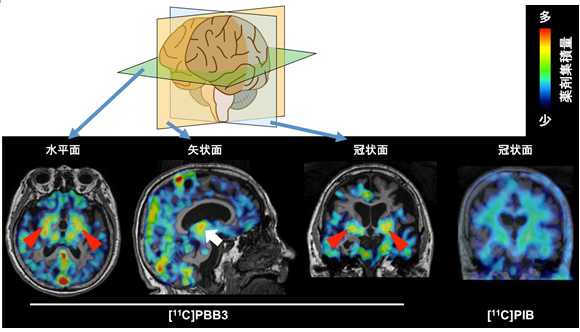
図5 皮質基底核変性症(非アルツハイマー型認知症)の患者におけるPET画像
[11C]PBB3の脳内集積は、大脳皮質でも軽度上昇を認めたが、大脳基底核(矢頭)や脳幹(矢印)での集積増加が顕著であった。これらの領域は皮質基底核変性症でタウが蓄積する脳部位と一致した。[11C]PIBの脳内集積は見られず、Aβは蓄積していないと考えられる。
<用語解説>
- 注1) タウ
- 神経系細胞の骨格を形成する微小管に結合するタンパク質。細胞内の骨格形成と物質輸送に関与している。アルツハイマー病をはじめとするさまざまな精神神経疾患において、タウが異常にリン酸化して細胞内に蓄積することが知られている。
- 注2) PET
- 陽電子断層撮影法(Positron Emission Tomography)の略称。身体の中の生体分子の動きを生きたままの状態で外から見ることができる技術の一種。特定の放射性同位元素で標識したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量などを三次元的に測定できる。
- 注3) アミロイドベータ(Aβ)
- アルツハイマー病やダウン症候群にみられる病理学的変化である老人斑、脳アミロイド血管症(アミロイドアンギオパチー)の主成分の1つ。Aβ自身も神経細胞に毒としての作用を及ぼすことが報告されている。
- 注4) PBB3
- 今回開発した、脳内に蓄積したタウに対して選択的に結合する薬剤。PBB3のPBBはPyridinyl-Butadienyl-Benzothiazoleの略称。蛍光物質であることから、生体蛍光画像を得るのにも利用できるが、PBB3を放射性同位元素で標識することにより、PET薬剤として使用できる。生体蛍光画像は細胞レベルの詳細な観察を可能にするが、脳の深部を観察することは困難である。PETは脳の深部観察を可能にし、ヒトにも応用可能である。
- 注5) 認知症モデルマウス
- 主に遺伝子操作によって、認知症の中核病理(の一部)が出現するようになったマウス。本研究で用いたモデルマウスは、ヒトのタウ遺伝子を組み込んでタウを過剰に発現させ(トランスジェニックマウスと呼ばれる)、リン酸化タウが神経細胞内に蓄積するマウスである。タウ蓄積に伴って、神経細胞死や認知症の症状に似た行動異常が出現する。診断薬や治療薬を開発する際の基礎的な評価に利用される。
- 注6) 皮質基底核変性症
- 物忘れに加えて多彩な運動障害をきたす難病の一種。脳内に異常にリン酸化したタウが蓄積することが知られているが、詳細な原因は不明で、根本的な治療法もない。予後不良で、約5~10年で寝たきりになる。
- 注7) PIB
- ピッツバーグ化合物B(Pittsburgh Compound-B)の略称。脳内に蓄積したAβに選択的に結合するPET薬剤である。高いコントラストでAβ病変を画像化できることから、これまで数多くの研究で使用されている。
<お問い合わせ先>
<研究内容に関すること>
独立行政法人 放射線医学総合研究所 分子イメージング研究センター 分子神経イメージング研究プログラム チームリーダー
樋口 真人
TEL:043-206-4700 FAX:043-253-0396
E-mail:
<報道担当>
独立行政法人 放射線医学総合研究所 企画部 広報課
TEL:043-206-3026 FAX:043-206-4062
E-mail:
<JSTの事業に関すること>
独立行政法人 科学技術振興機構 戦略研究推進部
TEL:03-3512-3524 FAX:03-3222-2064
E-mail: