ポイント
- マウスの心臓線維芽細胞からiPS細胞を経ずに心筋様細胞を直接作製できることは報告されていたが、マウスと同じ因子では、ヒト心筋様細胞を直接作製することはできなかった。
- 5つのヒト心筋誘導遺伝子の同定に成功し、その遺伝子の導入によりヒト心臓線維芽細胞から心筋様細胞を直接作製できることを明らかにした。
- 心筋梗塞などで線維化した組織を心筋組織に戻す新しい心臓再生医療への発展が期待できる。
JST 課題達成型基礎研究の一環として、慶應義塾大学 医学部の家田 真樹(イエダ マサキ) 特任講師、和田 りえ 研究技術員らは、ヒトの心臓線維芽細胞注1)からiPS細胞注2)を経ずに直接心筋様細胞注3)を作製する方法を開発しました。
家田特任講師らは、新しい心臓再生法として心臓に存在する心筋以外の心臓線維芽細胞に遺伝子を導入するだけで心筋を再生する研究を行っています。これまでに、マウス生体内にある心臓線維芽細胞に3つの遺伝子を導入して直接心筋様細胞を作製できることを報告してきましたが、再生医療実現化のためにはヒトの細胞で直接的に心筋を作製する方法の開発が望まれていました。
本研究グループは、3つのマウス心筋誘導遺伝子注4)に新たに遺伝子を1つずつ加えてヒト心筋誘導因子のスクリーニングを行い、最終的に5つの遺伝子の同時導入によりヒト心臓線維芽細胞からiPS細胞を経ずに直接心筋様細胞を作製できることを明らかにしました。
この方法は(1)心臓線維芽細胞から未分化な細胞を介さず心筋様細胞のみを作製するためがん化のリスクが少ない(2)生体内で直接心筋様細胞を作製するため細胞移植の必要がなくなる(3)心筋梗塞などの心臓障害後の線維化組織を心筋組織に戻すことができる、などこれまでの心臓再生の課題を解決できる可能性があり、心臓病に対する新しい再生医療につながることが期待されます。
本研究は、慶應義塾大学 医学部 小児科の山岸 敬幸(ヤマギシ ヒロユキ) 准教授、同 心臓血管外科の饗庭 了(アエバ リョウ) 准教授らの協力を得て行いました。
本研究成果は、米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版で2013年7月15日(米国東部時間)の週に公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」
(研究総括:須田 年生 慶應義塾大学 医学部 教授)
|
| 研究課題名 |
「直接リプログラミングによる心筋細胞誘導の確立と臨床への応用」 |
| 研究代表者 |
家田 真樹(慶應義塾大学 医学部 特任講師) |
| 研究期間 |
平成22年10月~28年3月 |
JSTはこの領域で、革新的医療に資する細胞リプログラミング法を用いた基盤技術の開発を目指している。上記研究課題では、線維芽細胞から心筋細胞への直接リプログラミング法の開発とその臨床応用を目指している。
<研究の背景と経緯>
心臓では、心筋梗塞、拡張型心筋症などの心臓病で心筋細胞が失われると、その部分は心臓内にある線維芽細胞の増殖、線維化により置き換えられ心臓ポンプ機能が低下します。iPS細胞などの多能性幹細胞は高い増殖能とさまざまな細胞に分化できる多能性を持ち、幹細胞から作製できる心筋細胞は心臓病に対する細胞移植治療の細胞源として期待されています。しかし、幹細胞を用いる心臓再生治療の課題として、幹細胞混入に伴う腫瘍形成の可能性、心臓に適した細胞移植法の開発、移植後の細胞の長期生着の問題などがあります。また現時点では、心臓病で一度線維化してしまった組織を元の心筋組織に戻す治療法はありません。
家田特任講師らは、幹細胞を用いるこれまでの心臓再生法とは異なる新しい心臓再生法として、臨床医として心臓組織や細胞を見てきた経験から心臓の中に存在する心筋以外の細胞「心臓線維芽細胞」を心筋再生の細胞源として使うという新たな発想に基づく研究を開始しました。
心臓を構成する細胞を見ると、心筋細胞は全体の30%程度で、残り50%以上はポンプ機能を持たない心臓線維芽細胞で占められています。また心臓病では心筋細胞数が減少し、心臓線維芽細胞がさらに増殖して線維化、心不全を増悪させます。心臓内に多数存在するこの線維芽細胞を心筋細胞へと直接転換することができれば、幹細胞を用いた医療に伴う上記の問題点を解決できる可能性があります。
本研究に先駆け、2010年に家田特任講師らはマウス心筋細胞を作り出すために必要な「心筋誘導遺伝子」(iPS細胞を樹立する時の「山中ファクター」にあたる)として、Gata4、Mef2c、Tbx5を同定しました。そして、この3つの遺伝子を培養皿上のマウスの心臓線維芽細胞に導入すると、線維芽細胞はiPS細胞を経ることなく直接心筋様細胞に転換することを見いだしました(図1)(Ieda et al, Cell, 2010)。また、2012年にはマウス生体内に3つの心筋誘導遺伝子を直接導入して、心臓内の線維芽細胞をその場で心筋様細胞へと転換し、心筋梗塞部位に新しい心筋を再生することに成功しました(図2)(Inagawa et al, Circ Res, 2012)。しかし、本技術を臨床応用するために必要である、ヒトの心臓線維芽細胞から心筋細胞を直接作製することが可能かどうかは、これまで不明でした。
<研究の内容>
本研究では、心臓病のため心臓外科手術を受けた患者から得られたヒト心臓線維芽細胞に、心筋誘導遺伝子を導入して心筋様細胞を直接作製できることを示しました。心臓線維芽細胞は心臓外科手術でカニュレーション注5)のため取り除かれる心筋組織から培養しました。通常は破棄される組織のため、患者に新たな負担を加えることはありません。また、本研究は全て大学の倫理委員会の認可を得ており、全ての患者から同意を得て心臓線維芽細胞を使用しました。
最初に、ヒト心臓線維芽細胞に3つのマウス心筋誘導遺伝子をレトロウイルスベクター注6)を用いて導入したところ、マウス細胞とは異なり心筋誘導が十分に見られませんでした。次に3つの心筋誘導遺伝子に、心筋細胞の誘導に重要と考えられた新たな11種類の候補遺伝子を1つずつ加えた計4遺伝子をヒト心臓線維芽細胞に導入して、心筋遺伝子の誘導を解析しました。その結果、11種類の候補遺伝子の中の「Myocd」あるいは「Mesp1」を心筋誘導遺伝子と同時に導入した時に、心筋細胞に特徴的な遺伝子の発現が上昇することが分かりました。さらに、心筋誘導遺伝子に「Myocd」と「Mesp1」の両方を加えた5つの遺伝子を同時に導入することで、その効果がさらに強まることを見いだしました。
また、5つの遺伝子(Gata4、Mef2c、Tbx5、Myocd、Mesp1)をレトロウイルスベクターを用いてヒト心臓線維芽細胞に遺伝子導入したところ、約5%の細胞で心筋の特徴を持つたんぱく質を発現するようになり、さらに心筋細胞と似た遺伝子発現様式を示すことが確認できました。細胞の形態や構造も心臓線維芽細胞から心筋様へと変化し、細胞内部には心筋に特徴的な横紋筋構造も確認できました(図3)。
2013年3月に米国の研究グループが、今回同定した5つの遺伝子とは異なる6つの心筋誘導因子注7)を用いてヒト心臓線維芽細胞から心筋様細胞を作製できたという結果を報告しました。しかし、作製した心筋様細胞が周りの細胞と協調して拍動可能かなど細胞の詳細な生理機能が不明であるという問題がありました。
家田特任講師らは、5つの遺伝子により作製した心筋様細胞を心筋細胞と同じシャーレ上で培養し細胞の詳細な機能解析を行いました。その結果、ほかの心筋細胞と一緒に培養することで心筋様細胞の成熟が進んで、周囲の細胞と協調して拍動することを確認できました(図4)。またこのヒト心筋様細胞は心臓線維芽細胞のほか、ヒト新生児の皮膚より採取された線維芽細胞からも作製することが可能でした。
次に、心臓線維芽細胞から心筋様細胞を誘導する際に、増殖力の高い未分化な細胞を経由していないか検討を行いました。その結果、ヒト心臓線維芽細胞は5つの遺伝子の導入により直接心筋様細胞へと分化転換し、未分化な幹細胞はその過程で誘導されないこと、また3カ月の長期間の培養でも細胞は腫瘍形成などを起こさないことを確認しました。
以上より、Gata4、Mef2c、Tbx5、Myocd、Mesp1という5つの遺伝子を同時に導入することで、ヒト心臓線維芽細胞からiPS細胞を介することなく直接心筋様細胞を作製できることが分かりました。今回の成果は新しい心臓再生医療の実現化を進める上で重要な知見を示すものと考えます。
<今後の展開>
今回の発見により、ヒト心臓線維芽細胞から直接心筋様細胞を作製できることが分かりました。心臓線維芽細胞が多数存在するヒト心臓の患部に、直接遺伝子を導入するだけで心筋を再生できる可能性があります。この技術は、従来のヒト心臓線維芽細胞からiPS細胞を作製し、iPS細胞から誘導した心筋を分離精製したのち患部に移植するという、これまでの心臓再生の工程を短縮単純化します。また幹細胞使用に関わる特有の問題点も解決できることが期待されます。現時点では、生体内への遺伝子導入法の確立、心筋様細胞の誘導効率の改善や安全性などの課題もありますが、本研究結果は心臓再生医療実現を前進させる大きな一歩であると考えられます(図5)。
<参考図>
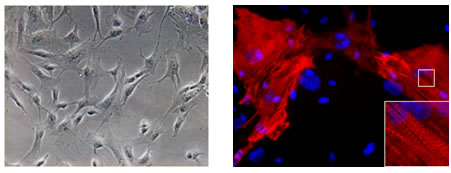
図1 マウスの心臓線維芽細胞から心筋様細胞の作製
同定した3つのマウス遺伝子(Gata4、Mef2c、Tbx5)を培養皿上のマウスの心臓線維芽細胞(左図)に導入すると、線維芽細胞はiPS細胞を経ることなく直接心筋様細胞(右図)に転換することを見いだした(Ieda et al, Cell, 2010)。右図の強拡大像は筋肉の横紋構造。
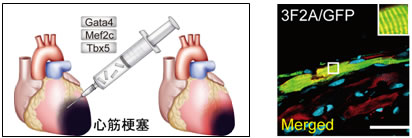
図2 心筋直接誘導法によるマウス心筋梗塞部位の再生
マウス生体内に3つの心筋誘導遺伝子を直接導入して心臓内の線維芽細胞をその場で心筋様細胞へと転換すると、心筋梗塞部位に新しい心筋が再生した(右図 生体内で作製したマウス心筋様細胞、Inagawa et al, Circ Res, 2012)。
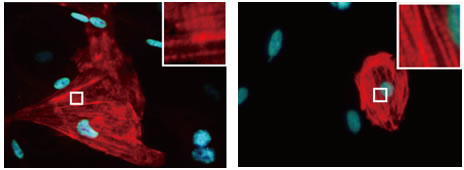
図3 Gata4、Mef2c、Tbx5、Myocd、Mesp1の導入により作製したヒト心筋様細胞
左)5つの遺伝子の導入により作製した心筋様細胞。
右)ヒトES細胞から作製した心筋細胞。5つの遺伝子により誘導された心筋様細胞は、その形態や構造も心臓線維芽細胞から心筋様へと変化し、細胞内部には心筋に特徴的な横紋筋構造(強拡大像)も確認することができる(Wada et al, PNAS, 2013)。
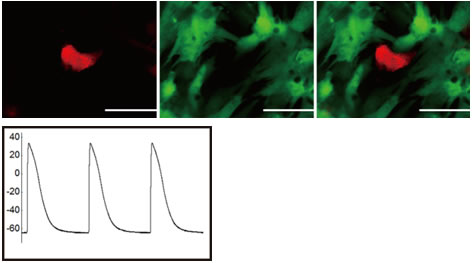
図4 作製したヒト心筋様細胞の機能
上図)心臓線維芽細胞から作製した心筋様細胞は(左、赤い細胞)、ほかの心筋細胞(真ん中、緑色の細胞)と一緒に培養することで成熟が進み周囲の細胞と協調して拍動するようになる(右、重ね合わせ図)。
下図)心筋様細胞の電気活動で心筋に特徴的である(Wada et al, PNAS, 2013)。
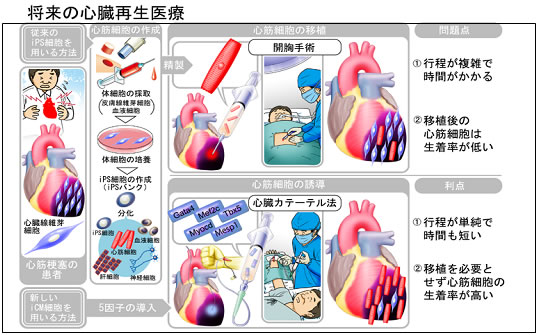
図5 将来の心臓再生医療
従来の方法の問題点(上)と今回の研究成果より得られたヒト心筋様細胞直接誘導法の利点(下)の比較。将来的に、心臓カテーテル法を用いて、心臓患部に直接遺伝子を導入して心筋細胞を作製し、心臓再生医療を行うことが期待される。
<用語解説>
- 注1) 心臓線維芽細胞
- 心臓線維芽細胞は心臓内結合組織を構成する細胞で細胞外基質、液性因子を分泌する。細胞数は心臓内で50%以上を占める最も数の多い細胞種である。心筋梗塞などの病態では、心筋細胞数の減少に伴い心臓線維芽細胞が増殖して線維化し、心不全を引き起こすことが知られている。
- 注2) iPS細胞
- 体細胞に特定の遺伝子(山中ファクター)を導入することにより樹立される、ES細胞のように多くの細胞に分化することができる人工多能性幹細胞。2006年に山中教授の研究グループにより世界で初めてマウス体細胞を用いて樹立された。
- 注3) 心筋様細胞
- 心臓線維芽細胞から誘導した心臓の筋肉細胞としてポンプの役割をする心筋細胞と同様の性質を示す細胞。心筋細胞、心筋様細胞は分裂・増殖しない。
- 注4) 心筋誘導遺伝子
- 2010年に家田特任講師らが発見したマウス心筋様細胞を作り出すために必要な3つの遺伝子群(Gata4、Mef2c、Tbx5)で、iPS細胞を樹立する時の「山中ファクター」にあたる。この3つの遺伝子を心臓線維芽細胞に導入すると、iPS細胞を経ることなく心筋様細胞を直接作製できる。
- 注5) カニュレーション
- 心臓外科手術の際に必要な手技であり、脱血のためのチューブを挿入すること。本研究で使用したヒト心臓線維芽細胞はこの通常の医療行為に付随して得られるものであり、患者に新たな負担を強いることはない。
- 注6) レトロウイルスベクター
- ベクターとは、細胞外から内部へ遺伝子を導入する際の「運び屋」を指す。目的遺伝子をウイルスに組み込み、細胞に感染させることにより遺伝子を導入する。レトロウイルスベクターは、ウイルスベクターの1種で、線維芽細胞に遺伝子導入できる。
- 注7) 6つの心筋誘導因子
- 心筋誘導遺伝子と心筋誘導に関連する遺伝子発現を制御すると考えられるマイクロRNAを混合した6つの心筋誘導因子(Gata4、Hand2、Myocd、Tbx5、miR-1、miR-133)によりヒト心臓線維芽細胞から心筋様細胞を直接作製したという結果が、本年3月に米国の研究グループより報告された(Nam et al. 2013, PNAS)。一方、ほかの心筋細胞と一緒に培養することで作製した心筋様細胞の成熟が進み周囲の心筋と協調して拍動できるなど生理機能の改善を明らかにしたのは本研究が初めてである。
<論文タイトル>
“Induction of Human Cardiomyocyte-like Cells from Fibroblasts by Defined Factors”
(ヒト心臓線維芽細胞から心筋様細胞を直接誘導することに成功)
doi: 10.1073/pnas.1304053110
<お問い合わせ先>
<研究に関すること>
家田 真樹(イエダ マサキ)
慶應義塾大学 医学部 循環器内科教室
Tel:03-5843-6702 Fax:03-5363-3875
E-mail:
<JSTの事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2666
E-mail: