ポイント
- 特異的に標的分子(たんぱく質など)に阻害薬を輸送するドラッグデリバリ-型分子(DDM)システムを開発した。
- 子宮頚がん細胞や神経芽種細胞に過剰に発現するヒストン脱メチル化酵素(LSD1)の阻害剤は有力ながん治療薬として注目されている。
- LSD1だけを標的とする副作用の少ない新たな抗がん剤候補分子を作製。
JST 課題達成型基礎研究の一環として、京都府立医科大学の鈴木 孝禎 教授らは、新しい作用機序の抗がん剤候補分子を開発しました。
子宮頚がん細胞や小児がんの1つである神経芽腫細胞では、ヒストン脱メチル化酵素(LSD1)が過剰発現して、がん細胞の増殖に関与することが知られています。しかし、LSD1の働きだけを阻害する抗がん剤はありませんでした。これは、LSD1に類似した構造を持つモノアミン酸化酵素(MAO)注1)が存在するために、このMAOを阻害せずに、LSD1だけを特異的に阻害する分子の開発が困難であったためです。
例えば、MAOを阻害して神経伝達物質の量を調節する抗うつ薬として臨床で使われているトラニルシプロミンは、構造が類似するLSD1も阻害して抗がん作用を示すことが動物実験で分かっています。しかし、トラニルシプロミンを抗がん剤として使用する場合には、本来の抗うつ薬としての神経性の副作用が予想されるため、抗がん剤としての用途には限界があります。
今回鈴木教授らは、このトラニルシプロミンをLSD1だけに特異的に輸送して結合させる「たんぱく質を標的としたドラッグデリバリー型分子(DDM)」を作製しました。このトラニルシプロミンが連結したDDM(NCD33)は、LSD1だけに結合して、がん細胞の増殖を抑える効果があることを明らかにしました。さらに、トラニルシプロミンよりも活性が300倍も高い新しい抗がん剤候補分子であることを確認しました。
今回作製したNCD33分子を基に、今後副作用の少ない新たな抗がん剤の開発が期待されます。
本研究は、長浜バイオ大学の水上 民夫 教授と共同で行ったもので、研究成果は、ドイツ科学誌「Angewandte Chemie International Edition」のオンライン速報版で近日中に公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「エピジェネティクスの制御と生命機能」
(研究総括:向井 常博 西九州大学 学長) |
| 研究課題名 |
「エピジェネティクス制御化合物の創製と応用」 |
| 研究者 |
鈴木 孝禎(京都府立医科大学 大学院医学研究科 統合医化学専攻 医薬品化学 教授) |
| 研究期間 |
平成21年10月~平成25年3月 |
JSTはこの領域で、エピジェネティクス注2)の制御と生命機能の解明という視点を持った研究を対象とします。より詳しくは、エピジェネティクスの制御機構の解明、さまざまな生命現象とエピジェネティクスの関わり、エピジェネティクスの多様性や異常が関わる疾患の解析を対象とします。それらの研究を通してエピジェネティクスの生命機能としての分子基盤を明らかにすることで、細胞リプログラミングに立脚した幹細胞作製・制御による革新的医療基盤技術の創出を目指します。
<研究の背景と経緯>
子宮頚がんは、子宮頸部と呼ばれる子宮の出口より発生するがんです。ヒト乳頭腫ウイルスの感染によって発症します。日本での子宮頚がんの罹患者数は2005年のデータで約8,500人、死亡数は2008年のデータで約2,500人と報告されています。子宮頚がん予防のために、日本国内では2009年10月にワクチン認可がされましたが、ワクチン接種後の慢性的な痛みなどの副作用が報告されています。また、神経芽腫は小児がんの1つで、副腎や交感神経節などの神経細胞の集まる場所に腫瘍ができるがんです。小児がん患者全体の約1割を占め、およそ10万人に8人~9人の割合で症状が出るといわれています。日本での正確な発生数は明らかではありませんが、1年間に150~200例が発症すると考えられています。
子宮頚がん細胞や神経芽腫細胞増殖のメカニズムは、徐々に明らかになりつつあり、最近、ヒストン脱メチル化酵素LSD1が子宮頚がん細胞や神経芽腫細胞の増殖に関わることが示されました。
LSD1は、細胞の核内でDNAが巻き付いているヒストンたんぱく質注3)からメチル基を取り除くことにより、遺伝子の発現制御に関わっています(こうした後天的な遺伝子発現の制御を、エピジェネティックな遺伝子発現制御と呼びます)。LSD1は、子宮頚がん細胞や神経芽腫細胞に過剰に発現しており、がん抑制遺伝子の働きを抑えることで、がん細胞の増殖を強く進めることから(図1)、LSD1阻害剤は新たな抗がん剤として期待されています。
しかし、LSD1の構造に似た酵素であるモノアミン酸化酵素(MAO)を阻害せず、LSD1だけを強く阻害する分子の開発は困難です。例えば、抗うつ薬として臨床で用いられているMAO阻害剤「トラニルシプロミン」がLSD1も阻害し、培養細胞実験および動物実験で抗がん効果を示すことが知られています(図2)。このトラニルシプロミンを、がん細胞だけに送り込むことができれば、トラニルシプロミンは新たな抗がん剤の候補になるはずですが、現在のところ、LSD1阻害剤として臨床で用いられている治療薬はありません。
標的とする患部だけに薬物を効果的かつ集中的に送り込む手法は、これまでも開発されてきました。例えば、薬剤の高分子化や複雑な製剤化により、抗がん剤をがん細胞に集積させる手法があります。しかし、いずれもコストが高くなる、投与方法が注射剤に制限されるなどの問題がありました。
<研究の内容>
今回鈴木教授らは、「患部」ではなく「たんぱく質」を標的とした全く新しいドラッグデリバリーのコンセプトを提唱し、LSD1だけを阻害する小分子薬剤の開発に取り組みました。LSD1のようにがん細胞にだけ過剰に発現するたんぱく質を標的とすることができれば、副作用を抑えることができ、より高い治療効果が臨める可能性があります。また、小分子薬剤であれば低コスト化も期待でき、投与方法も制限されません。
まず、LSD1だけを阻害する抗がん剤候補化合物を見いだすために、トラニルシプロミンをLSD1に導くためのドラッグデリバリー型分子(図3)を設計しました。この分子は、LSD1のみに強く結合する構造(輸送体)を持っています。トラニルシプロミンをつなげた輸送体は、トラニルシプロミンをLSD1に運び込み、LSD1に結合すると同時にトラニルシプロミンと離れ、そのトラニルシプロミンがLSD1内のFADと結合することを期待しました(図3)。実際にこの分子を合成し、試験管内実験を行った結果、合成化合物の1つであるNCD33は、実際にMAOを全く阻害することなく、トラニルシプロミンよりも80倍強くLSD1を阻害しました(図4)。また、作用メカニズム解析により、NCD33は、図3に示す機序で、すなわち輸送体部分がトラニルシプロミンをLSD1に運び込みLSD1と結合させた後、輸送体部分はLSD1から立ち去るというメカニズムで、LSD1だけを強く阻害することも示しました。さらに、これらの分子の1つは、培養細胞系で子宮頚がん細胞の増殖をトラニルシプロミンよりも135倍以上強く抑えること、神経芽腫細胞の増殖をトラニルシプロミンよりも300倍強く抑えることを明らかにしました(図5)。
<今後の展開>
今回の研究で、これまで抗うつ薬として長期に使用されてきたMAO阻害剤「トラニルシプロミン」をもとに、がん細胞の増殖の原因となるLSD1を特異的に不活性化する分子が見いだされました。この分子は、子宮頚がんや神経芽種などの新たな抗がん剤候補になります。まだ培養細胞で効果を確かめた段階であり、ヒトで効くかどうかはさらなる研究が必要ですが、鈴木教授らは、動物実験で効果や安全性を確かめ、臨床への応用を進めていく予定です。また、今回効果が実証された、「患部ではなくたんぱく質を標的としたドラッグデリバリー」をもとにして、LSD1阻害剤以外にも、副作用の少ない新たな抗がん剤の開発が期待されます。
<付記>
本成果は、JST 研究成果最適展開支援事業 フィージビリティスタディ 可能性発掘タイプ シーズ顕在化の研究課題「エピジェネティクス新規制御分子LSD1を標的とする次世代分子標的抗がん剤の開発」(研究代表者:水上 民夫 長浜バイオ大学 教授)の協力により得られました。
<参考図>
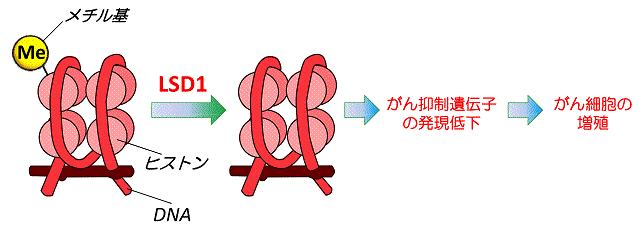
図1 LSD1によるヒストン脱メチル化
DNAは、細胞内ではヒストンたんぱく質に巻き付いた状態で存在する。ヒストンたんぱく質にメチルという化学物質が付くかどうかで、周辺遺伝子の発現量が制御されている。LSD1がヒストンを脱メチル化する、エピジェネティックな機構によって、がん抑制遺伝子の働きが抑えられ、がん細胞が増殖する。
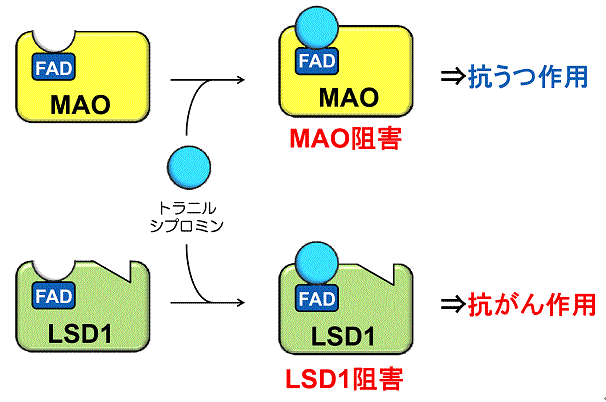
図2 抗うつ剤「トラニルシプロミン」の作用機序
(上)トラニルシプロミンは、MAOに結合し、MAOの補酵素注4)として働くフラビンアデニンジヌクレオチド(FAD)注5)に結合してMAOを阻害し、抗うつ作用を示す。
(下)トラニルシプロミンはLSD1の補酵素であるFADに結合してLSD1も阻害する。トラニルシプロミンのLSD1阻害による抗がん作用が期待される一方で、MAO阻害による神経性の副作用が予想され、トラニルシプロミンの抗がん剤としての用途には限界がある。
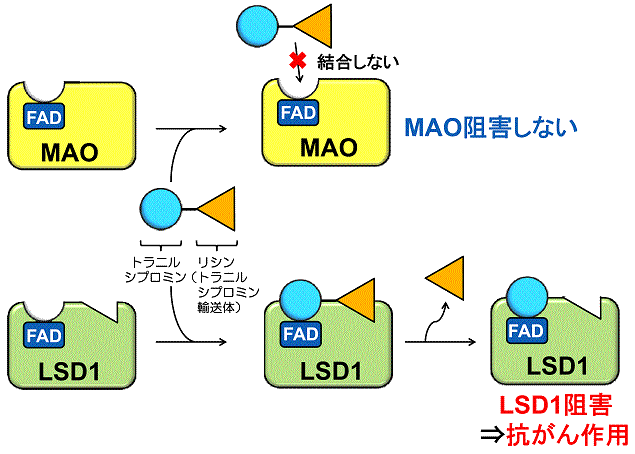
図3 トラニルシプロミンをLSD1にだけ運び込むドラッグデリバリー型分子
(上)トラニルシプロミン-リシン結合体は、リシン部分が邪魔でMAOに結合できないため、MAOを阻害しない。MAO阻害による神経性の作用もない。
(下)トラニルシプロミン-リシン結合体は、リシン部分(輸送体部分)がトラニルシプロミンをLSD1の補酵素FADまで運び込み、FADとトラニルシプロミンを結合させる。これによりLSD1が阻害され、抗がん作用を示す。
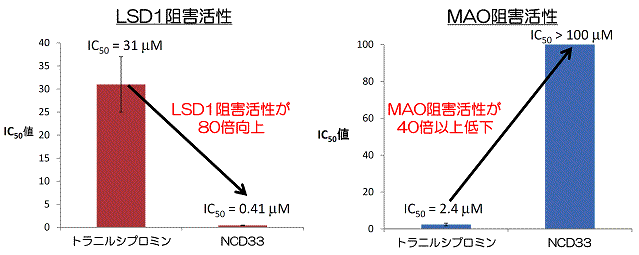
図4 トラニルシプロミンとNCD33のLSD1阻害活性およびMAO阻害活性
IC50値:酵素の活性を50%阻害する濃度。化合物の酵素阻害作用の有効度を示す値であり、その値が小さいほど活性が高い化合物であると判断できる。
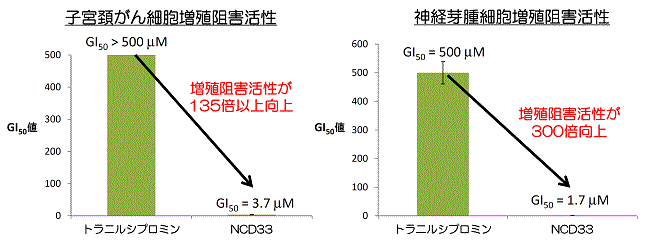
図5 トラニルシプロミンとNCD33のがん細胞増殖阻害活性
GI50値:細胞の増殖を50%阻害する濃度。化合物の細胞増殖阻害作用の有効度を示す値であり、その値が小さいほど活性が高い化合物であると判断できる。
<用語解説>
- 注1) モノアミン酸化酵素(MAO)
- 神経伝達物質であるノルアドレナリンやセロトニン、ドーパミンなどの酸化を促進する酵素。神経系において神経伝達物質の量を調節する。MAO阻害剤は、パーキンソン病治療薬、抗うつ薬として使用されている。
- 注2) エピジェネティクス
- ゲノムに書かれた遺伝情報であるDNA塩基配列の変化を伴わずに、遺伝子の働きを制御する機構。DNAのメチル化やヒストンのアセチル化、メチル化などがエピジェネティクス機構としてよく知られている。エピジェネティクス制御機構の異常が種々のがんを引き起こすことが分かってきた。
- 注3) ヒストンたんぱく質
- 細胞の中でDNAを核内に収納する役割を担うたんぱく質。遺伝子発現を制御するたんぱく質でもある。ヒストンやDNAは、染色体中に含まれる(下図)。
- 注4) 補酵素
- 酵素が起こす生体内化学反応の進行に必要な低分子化合物の総称。酵素と補酵素が直接結合することで、酵素は生体内化学反応を進行させることができる。
- 注5) フラビンアデニンジヌクレオチド(FAD)
- 生体内でビタミンB2から作られる。生体内にある多くの酸化反応の補酵素として働く。
<論文タイトル>
“Lysine-Specific Demethylase 1-Selective Inactivators: Protein-Targeted Drug Delivery Mechanism”
(リシン特異的脱メチル化酵素1選択的不活性化薬:たんぱく質を標的としたドラッグデリバリー機構)
doi: 10.1002/anie.201303999
<お問い合わせ先>
<研究に関すること>
鈴木 孝禎(スズキ タカヨシ)
京都府立医科大学 大学院医学研究科 統合医化学専攻 医薬品化学 教授
〒603-8334 京都府京都市北区大将軍西鷹司町13
Tel/Fax:075-465-7659
E-mail:
<JSTの事業に関すること>
木村文治(キムラ フミハル)、川口 貴史(カワグチ タカフミ)、落合 恵子(オチアイ ケイコ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2063
E-mail: