ポイント
- がん細胞の根源であるがん幹細胞はほとんど増殖しない冬眠状態のため、抗がん剤が効かない。
- 冬眠の維持に必要なたんぱく質「Fbxw7」を無力化すると、がん幹細胞が眠りから覚めて、抗がん剤で死滅することを発見。これを「静止期追い出し療法」と命名。
- 白血病をはじめとする多くのがんの根本治療の実現に期待。
JST 課題達成型基礎研究の一環として、九州大学 生体防御医学研究所の中山 敬一 主幹教授らは、細胞周期注1)を調節するたんぱく質であるFbxw7注2)を抑制することによって、がん幹細胞を直接たたき、生存率を大幅に改善させることに成功しました。
近年、がん研究においては「がん幹細胞」が注目されています。「がん幹細胞」自体は非常に数が少なく、それ自体はほとんど増殖しません(冬眠状態=静止期)。しかしその子孫である「がん細胞」は急速に増殖し、最終的に生命を脅かします。従来の抗がん剤や放射線療法は、この急速に増殖する「がん細胞」を一時的に殺すことができても、あまり増殖しない「がん幹細胞」にはほとんど効果がありません。治療後に残存したがん幹細胞から再びがん細胞が生じ、再発や転移を引き起こすと考えられるため、がんの根本的な治療にはなっていませんでした。つまり、がんを完全に治療するためには、このがん幹細胞を根本的にたたく方法の開発が必要ですが、がん幹細胞が静止期にある基本的なメカニズムが明らかになっていなかったため、効果的な治療法がありませんでした。
本研究チームは、がん幹細胞が静止期にとどまる機構を明らかにし、その中心的なたんぱく質Fbxw7を発見しました。実際に慢性骨髄性白血病モデルマウス注3)で人工的にFbxw7を欠損させる注4)と、白血病のがん幹細胞が静止期から追い出され、増殖が再開して抗がん剤で死滅しました。つまり「Fbxw7の抑制」+「抗がん剤」の併用により、治療後の再発を減少させ、生存率を大幅に改善させることに成功しました。このがん幹細胞を撲滅する新方法を「静止期追い出し療法」と命名しました。
本研究は、Fbxw7ががん幹細胞の増殖を抑制し、治療抵抗性の原因となっていることを示した初めての報告です。Fbxw7の働きを抑える阻害剤が実現すれば、がん根治療法を実現することが期待されます。
本研究成果は、2013年3月18日(米国東部時間)に米国科学雑誌「Cancer Cell」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「生命システムの動作原理と基盤技術」
(研究総括:中西 重忠 (公財)大阪バイオサイエンス研究所 所長)
|
| 研究課題名 |
「ユビキチンシステムの網羅的解析基盤の創出」 |
| 研究代表者 |
中山 敬一(九州大学 生体防御医学研究所 主幹教授) |
| 研究期間 |
平成19年10月~平成25年3月 |
JSTはこの領域で、生命システムの動作原理の解明を目指して、新しい視点に立った解析基盤技術を創出し、生体の多様な機能分子の相互作用と作用機序を統合的に解析して、動的な生体情報の発現における基本原理の理解を目標としています。上記研究課題では、細胞分裂、DNA修飾、たんぱく質の品質管理など重要な生命現象を調節するユビキチンシステムについて、遺伝学とプロテオミクスを組み合わせた新しい方法によって網羅的に解析し、システムの全体像を解明することを目指しています。
<研究の背景と経緯>
近年、がん組織を構成している細胞群にはヒエラルキー(上下関係)が存在し、多くの「がん細胞」はこのヒエラルキーの最上位に位置するごく少数の「がん幹細胞」から生じると考えられるようになっています。これまでの研究により、このがん幹細胞は抗がん剤治療や放射線療法などの従来のがん治療に抵抗性を示すことが知られています。そのため、がん治療によってがん細胞が死滅し、がんが治癒したと思われる場合でも、その多くの場合ごく少数のがん幹細胞が残存しています。原発巣(最初にがんが発生した場所)において、この残存したがん幹細胞から再びがん細胞が生じるのが「再発」であり、がん幹細胞が他の部位へ移動しがん細胞を生じるのが「転移」です(図1)。
がん幹細胞の治療が難しい原因として、がん幹細胞がほとんど増殖活動をしていないことが挙げられます。「がん」という言葉を聞くと、盛んに増殖している細胞をイメージしますが、がん幹細胞は増殖期を脱出して「静止期」と呼ばれる特殊な冬眠状態にとどまっており、細胞増殖をほとんど行っていません。がん幹細胞が発見される以前のがん治療は、がん細胞の増殖を抑制することを目的として開発されてきたために、静止期に維持されているがん幹細胞には効果を発揮できないと考えられています(図2)。従って、がん幹細胞を静止期から増殖期に移行させることにより、がん幹細胞の治療抵抗性を破綻させることが可能になれば、がん根治療法の開発に直結すると期待されますが、がん幹細胞がどのようなメカニズムで静止期に維持されているのかは今までよく分かっていませんでした。本研究チームは、がん幹細胞を静止期に維持させている因子の候補として、Fbxw7という分子に着目しました。Fbxw7には細胞分裂を抑制する働きがあることが知られていましたが、Fbxw7のがん幹細胞における役割はいまだ不明のままでした。
<研究の内容と経緯>
本研究チームはまず、慢性骨髄性白血病のモデルマウスを作製し、この白血病マウスで人工的にFbxw7を欠損させ、解析を行いました。その結果、Fbxw7の欠損により、がん幹細胞の増殖抑制が解除されることが判明しました(図3)。すなわち、Fbxw7はがん幹細胞を静止期に維持するための必須の分子だったことが明らかとなりました。
次に、Fbxw7を欠損したがん幹細胞の抗がん剤感受性を調べるために、白血病マウスに慢性骨髄性白血病の標準治療薬(抗がん剤)であるイマチニブ注5)を投与しました。イマチニブはがん細胞を殺す効果はありますが、がん幹細胞には効果がないことが知られており、イマチニブの服薬を中止すると約60%の患者が白血病を再発することが分かっています。
マウスにおいても、イマチニブの投与中は白血病を抑えるものの、投与を止めるといずれ再発してほとんどのマウスが死亡することが分かりました(図4)。これはイマチニブががん細胞を殺すことができても、がん幹細胞には効果がないことを示しています。しかし、がん幹細胞でFbxw7を欠損させると、このがん幹細胞はイマチニブによって死滅して消失し、イマチニブ投与中止後も再発せず、生存率が著明に改善しました(図4)。この結果は、Fbxw7を欠損したがん幹細胞が静止期を脱出して増殖期に入るため、抗がん剤(イマチニブ)に対して感受性になり、殺傷された結果です(図5)。
以上の結果から、がん幹細胞の静止期の維持に必要なFbxw7を抑制することによって、がん幹細胞を静止期から追い出した後、抗がん剤を投与することにより、がん幹細胞を根絶させ、治療後の再発率を大幅に改善することが可能であることが判明しました。本研究チームは、この新方法を「静止期追い出し療法」と名付けました。本研究によりがん幹細胞の治療が難しかった仕組みの一端が明らかとなり、今後のさらなる研究の進展が注目されます。
<今後の展開と応用への期待>
イマチニブの開発は慢性骨髄性白血病の病状の見通しを劇的に改善しましたが、イマチニブ投与により2年以上寛解注6)を維持している患者において投与を中止すると、その約60%において早期再発が認められることが報告されています。つまり、寛解を維持するためにはイマチニブを継続投与する必要があり、患者にとっては多大な経済的負担となります。本研究では、Fbxw7を欠損させた場合、イマチニブ投与を中止しても再発はほとんど見られませんでした。従って、Fbxw7の働きを抑える阻害剤が開発されれば、がん幹細胞を死滅させることによる白血病の根治が見込まれると期待されます。
がん幹細胞は白血病をはじめとして、これまでに乳がん、脳腫瘍、大腸がんなどさまざまながんにおいて同定されています。これまでの研究により、これらのがんにおけるがん幹細胞は、生物種や臓器の枠組みを超えた共通の細胞生物学的特性を数多く持つことが明らかとなっています。従って、Fbxw7は白血病のみならず、他のがん幹細胞においても治療抵抗性の原因となっている可能性があります。他のがんにおいてFbxw7による細胞増殖の静止が確認されれば、Fbxw7阻害剤を開発することにより、慢性骨髄性白血病だけでなく、多くのがんにおいて根治療法の確立が期待されます。
<参考図>
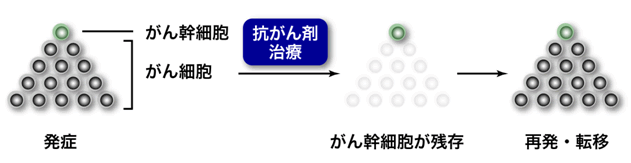
図1 がん幹細胞によるがん組織の維持
がん組織を構成している細胞は、がん幹細胞から生み出されます。このがん幹細胞は抗がん剤治療などの従来のがん治療に抵抗性を示すことが知られています。従って、抗がん剤治療によってがん細胞が死滅し、がんが治癒したと思われる場合でも、その多くにおいてごく少数のがん幹細胞が残存しています。この残存したがん幹細胞から再びがん細胞が生じ、再発や転移を引き起こします。
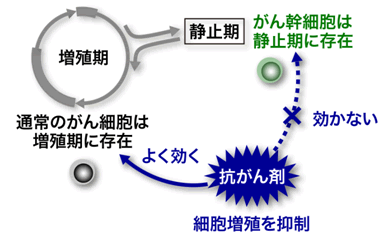
図2 がん幹細胞の治療抵抗性の原因
多くのがん細胞(黒)は異常な増殖能を獲得して、増殖期に存在しています。それに対して、がん幹細胞(緑)は増殖期から脱出して静止期にとどまっており、細胞増殖をほとんど行っていません。従来のがん治療はがん細胞の増殖を抑制することを目的として開発されてきたために、静止期に維持されているがん幹細胞には効果を発揮できないと考えられています。
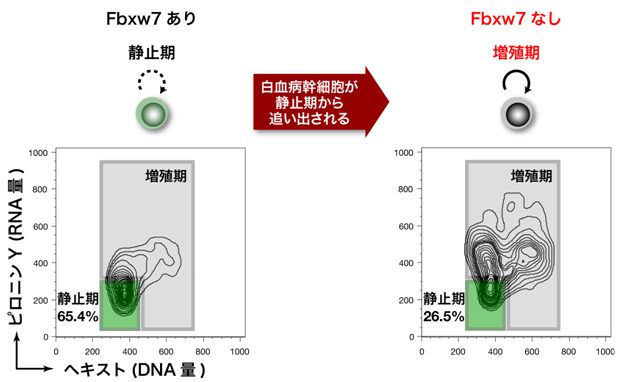
図3 がん幹細胞の静止期維持におけるFbxw7の役割
白血病マウスにおいてFbxw7を人工的に欠損させると、静止期に維持されているがん幹細胞(緑色の部分)が減少し、通常がん細胞と同様の静止期の割合になりました。このことは、Fbxw7ががん幹細胞の静止期を維持するための必須の分子であることを意味しています。
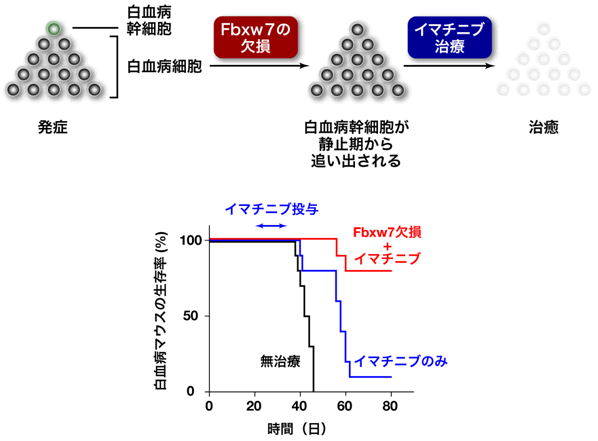
図4 Fbxw7の欠損とイマチニブの併用効果
イマチニブ投与のみ(青)でも白血病マウスの生存期間は延長しましたが、イマチニブ投与を中止すると、ほとんどのマウスにおいて再発が認められました。一方、Fbxw7を欠損させた後にイマチニブを投与する(赤)と、イマチニブ投与中止後もほとんどのマウスで再発が見られず、イマチニブ投与のみの場合と比較して生存率が大幅に改善しました。
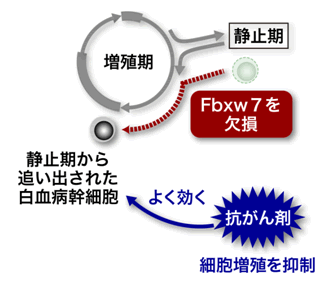
図5 Fbxw7を欠損したがん幹細胞の性質
Fbxw7を欠損させると、がん幹細胞が静止期を維持できなくなることが明らかになりました。そして、この静止期から追い出されたがん幹細胞は、抗がん剤に対して感受性を示すことを突き止めました。
<用語解説>
- 注1) 細胞周期
- 細胞は一定のサイクルで増殖を行っています。このサイクルのことを細胞周期といいます。
- 注2) Fbxw7
- 細胞分裂を抑制することにより、細胞増殖のブレーキとして働くと考えられているたんぱく質です。特に幹細胞における静止期の維持に必要だと考えられています。
- 注3) 慢性骨髄性白血病モデルマウス
- 慢性骨髄性白血病は、血液細胞においてBCRという遺伝子と、ABLという遺伝子が融合して発症します。今回はこの融合したヒト遺伝子をマウスの血液細胞に導入し、人工的に血液のがんである慢性骨髄性白血病を起こすモデルマウスとして使用しました。
- 注4) 人工的にFbxw7を欠損したマウス
- 遺伝子を操作することにより、目的の遺伝子を破壊・欠損させ、働かなくなるようにしたマウスです。今回はFbxw7遺伝子を人工的に欠損させたマウスを使用しました。
- 注5) イマチニブ
- 上記のBCRとABLが融合した遺伝子から作られるBcr-Ablを標的として開発されました。2001年から慢性骨髄性白血病の治療薬として使用されています。
- 注6) 寛解
- 白血病細胞が検出できなくなることを寛解といいます。
<論文名>
“Ablation of Fbxw7 Eliminates Leukemia-Initiating Cells by Preventing Quiescence”
(Fbxw7阻害は静止期を破綻させることにより白血病幹細胞を根絶する)
doi: 10.1016/j.ccr.2013.01.026
<お問い合わせ先>
<研究内容に関すること>
中山 敬一(ナカヤマ ケイイチ)
九州大学 生体防御医学研究所 分子医科学分野 主幹教授
〒812-8582 福岡県福岡市東区馬出3-1-1
Tel:092-642-6815 Fax:092-642-6819
E-mail:
<JSTの事業に関すること>
石正 茂(イシマサ シゲル)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: