<ポイント>
- 細胞質中のカルシウムイオン濃度分布は緑色のカルシウム蛍光試薬で可視化できるが、一般的な蛍光試薬やたんぱく質の多くも緑色に光るため、両者の併用が難しかった。
- 細胞質内に一様に分布する赤い蛍光試薬を独自開発し、カルシウムイオンの画像化に成功。
- この蛍光試薬は2013年4月に販売開始する予定。
JST 研究成果展開事業(先端計測分析技術・機器開発プログラム)の一環として、東京大学 大学院薬学系研究科の花岡 健二郎 准教授らの開発チームは、カルシウムイオンを赤く光らせて可視化する新しい蛍光試薬注1)『CaTM-2』の開発に成功しました。
カルシウムイオンは多くの生命現象に関わっており、筋収縮や脳神経活動などに伴って濃度分布が変化することが知られています。そのため、生きた細胞内部のカルシウムイオン濃度について、その時間的変動や場所の情報を画像や映像としてとらえることで、さまざまな生体活動の理解を深めることができます。
最も汎用性の高い蛍光色素として緑色の「フルオレセイン」が知られており、カルシウム蛍光試薬のほか、多くの蛍光試薬で利用されています。しかし、ほかの蛍光試薬や蛍光たんぱく質にも緑色のものが多いことから、これらを併用することができませんでした。一方、すでに実用化されているカルシウム蛍光試薬の中には赤い蛍光を発するものもありますが、細胞の中で特定部位にとどまる性質があることや検出感度が低いため、使用方法が限られていました。
開発チームは今回、赤く光るカルシウム蛍光試薬『CaTM-2』の開発に成功しました。『CaTM-2』は細胞の内部に一様に広がるとともに、カルシウムイオン濃度に応じて感度よく赤い蛍光を発します。実際に今回開発した『CaTM-2』と色の異なる蛍光試薬を併用することで、カルシウムイオンの濃度変化とラット脳神経細胞をそれぞれ可視化し、神経細胞が自然に興奮する「自然発火」と呼ばれる現象と神経細胞そのものを同時にとらえることに成功しました。
この成果は、複数の生体分子を異なる色の蛍光色素で可視化して同時に画像化する『マルチカラーイメージング注2)』を幅広い分野に応用することを可能にするものです。
本開発成果は、ドイツ科学雑誌「Angewandte Chemie International Edition」に近日中に掲載されます。また、本開発成果は2013年4月に五稜化学株式会社から発売される予定です。
本開発成果は、以下の事業・開発課題によって得られました。
| 事業名 |
研究成果展開事業(先端計測分析技術・機器開発プログラム) 要素技術タイプ
|
| 研究課題名 |
「次世代型蛍光プローブの創製を目指した新規蛍光団の開発」 |
| チームリーダー |
花岡 健二郎(東京大学 大学院薬学系研究科 准教授) |
| 研究期間 |
平成23~26年度(予定) |
| 担当開発総括 |
奥居 徳昌(東京工業大学 名誉教授) |
JSTはこのプログラムの要素技術タイプで、計測分析機器の性能を飛躍的に向上させることが期待される新規性のある独創的な要素技術の開発を目指しています。
<開発の背景と経緯>
生命現象を理解するためには、生体内で起こるさまざまな現象をリアルタイムで高感度に観察することが重要です。蛍光イメージングはこのような観察を可能にする手法の1つで、蛍光試薬や蛍光たんぱく質を用いて分子や細胞などを可視化します。この技術は今日の生物学研究を行う上で必須の技術となっており、緑色蛍光たんぱく質を発見した下村 脩 博士が2008年のノーベル化学賞を受賞していることからも、その重要性が分かります。
信頼性のある蛍光イメージングを達成するためには、細胞外から細胞内へと導入可能で、高い感度と選択性を持つことに加え、細胞への障害も低いなど、多くの条件を満たす優れた蛍光試薬の開発が不可欠です。さらに近年では、複数の分子や細胞を異なる色の蛍光試薬などで色分けすることによって、それらの分布の違いや相互作用の有無などを直接観察する「マルチカラーイメージング」への要望が高まっています。この技術を使えば、さまざまな細胞が含まれている組織について、特定の細胞と特定の生体分子をそれぞれ別の色で蛍光標識することで、対象細胞の内部での生体分子の分布を観察することができます。また、細胞間で情報を伝達する「シグナル伝達物質」が特定のたんぱく質の発現を引き起す場合、それらを異なる蛍光色素で同時に観察して、その現象がどのようなタイムスケールで生じているのかを解析することができます。
従来から広く用いられている代表的な蛍光試薬では、「フルオレセイン」と呼ばれる緑色の蛍光色素が知られています(図1左)。フルオレセインは水溶性が極めて高いことに加えて高い蛍光輝度を持つ上に、蛍光制御機構が確立されているなどの特徴があり、多くの蛍光試薬に用いられています。フルオレセインを含む緑色蛍光試薬は、あらゆる生物学研究に必要不可欠なものとなっていますが、他の緑色蛍光試薬とは併用できない上に緑色蛍光たんぱく質を発現させた細胞や動物にも用いることができないという問題がありました。
2011年、花岡准教授らはフルオレセインの優れた特性を保持したまま、赤く光る蛍光色素「TokyoMagenta(TM)」の開発に成功しました。TokyoMagentaは水溶液中における吸収波長と蛍光波長がともに、フルオレセイン(吸収波長:492nm、蛍光波長:509nm)と比較して90nmもの大きな長波長化を示すことから、緑色蛍光たんぱく質(GFP)や他の緑色蛍光色素と併用することが可能となりました。さらにTMは吸収・蛍光波長が長いことからフルオレセインに比べて組織透過性に優れている上に、光細胞毒性が小さいという利点があります。
一方、カルシウムイオンは生体の重要な二次的情報伝達物質(セカンドメッセンジャー注3))として知られており、細胞内のカルシウムイオン濃度の変動は、筋収縮や脳神経活動など多くの生命現象に関与します。そのため、カルシウム濃度の分布やその変動を蛍光イメージングで可視化して分析する研究は、生物学でも最も注目される分野の1つとなっており、現在は主に緑色のカルシウム蛍光試薬が利用されています。一部では赤色などのさらに長い波長の蛍光を発するカルシウム蛍光試薬も実用化されていますが、細胞内で特定の細胞小器官に局在することや蛍光強度が弱いため、限定的な利用にとどまっていました。
今回開発チームはTokyoMagentaを用いて、細胞質に均一に分布し、細胞内部におけるカルシウム濃度変化を可視化できる赤色蛍光色素の開発に成功しました。
<開発の内容>
これまでに開発チームは、ローダミンと呼ばれる蛍光色素の酸素原子をケイ素原子に置換することで、蛍光を発するために必要な光(励起光)と蛍光そのものの波長を長く変化させることに成功していました。開発チームは2011年に、フルオレセインの酸素原子をケイ素原子に置換することで同様の長波長化が起きることを期待してTokyoMagentaを合成し、励起光と蛍光の両方について長波長化を実現しました。
今回開発したのは、TokyoMagentaを用いた初めての実用的な赤色カルシウム蛍光試薬『CaTM-2』です。この蛍光試薬は、カルシウムイオンの濃度が高くなるにつれて強い蛍光を発することから(図2)、カルシウムイオンの濃度分布やその変化を可視化することができます。『CaTM-2』の蛍光強度は、励起光を受けたときに発生する電子移動の効率に応じて変化するので、その制御が開発成功の鍵でした。本開発ではカルシウムイオンを認識する部位と蛍光色素までの間の距離を最適化するために複数の候補分子を合成するなど、多くの検討を重ねることで、実用的な蛍光試薬の開発に成功しました。
CaTM-2はカルボン酸を4つ持っているために高い水溶性を示しますが、そのままでは脂質で構成された細胞膜をほとんど透過することができません。この課題を解決するため、開発チームではCaTM-2が持つ4つのカルボン酸をアセトキシメチル(AM)化して疎水性を高め、細胞膜を透過できるように改良した『CaTM-2 AM』の開発にも成功しました。細胞膜を透過したCaTM-2 AMは、細胞内に自然に存在する酵素(エステラーゼ)の働きで脱AM化されてCaTM-2となります。CaTM-2は細胞膜を通過することができないため、細胞内にとどまります。この成果により、CaTM-2 AMを含む培地で細胞を数十分間培養するだけで、細胞の内部をCaTM-2で染色できるようになりました。また、細胞に取り込まれなかった過剰の蛍光試薬は細胞の表面を洗い流すだけで取り除けるので、培地に含まれるカルシウムイオンが観察に影響を及ぼすこともありません。
実際にCaTM-2 AMを用いて、生きた細胞がヒスタミン刺激を受けたときの細胞質内のカルシウムイオン濃度の変動を画像化することに成功しました(図3a-c)。比較のために、従来から使用されている赤く光るカルシウム蛍光試薬であるRhod-2を用いて同様の実験を行いました。Rhod-2はミトコンドリアに局在する性質があるため、細胞質におけるカルシウムイオン濃度変動の測定には適さないことが分かります(図3d-f)。
さらに、開発チームは、開発した蛍光試薬の生物学研究でのさらなる有用性を調べるため、ラット脳スライス切片をCaTM-2 AMと細胞体の染色に用いられるアクリジンオレンジで同時に染色しました。その結果、神経細胞の活動を発火に伴った細胞内のカルシウムイオンの濃度変動をCaTM-2 AMによって可視化することに成功しました(図4)。CaTM-2 AMのみを用いる場合は個々の細胞の同定が煩雑になりますが、アクリジンオレンジを併用することで細胞を一つ一つ明瞭に区別することができ、より詳細な可視化解析が可能となります。
<今後の展開>
今回開発に成功した赤く光るカルシウム蛍光試薬は、マルチカラーイメージングの可能性を大きく広げるものです。さらに本蛍光試薬は従来の赤色蛍光試薬と比較して蛍光輝度が高く細胞質に一様に分布するなど非常に実用性が高いため、世界の多くの研究者に広く提供されれば、生物学研究に与える影響は非常に大きいと考えられます。
なお、今回開発した赤色カルシウム蛍光試薬は、2013年4月に五稜化学株式会社から発売される予定です。
<参考図>
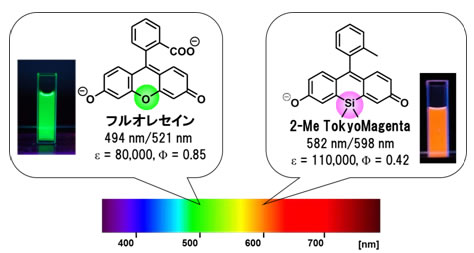
図1 フルオレセインと新たな赤色蛍光色素・TokyoMagenta
フルオレセインの緑色で示したO原子をSi原子(紫色で示した部分)に置換することで、赤色領域に吸収・蛍光波長(582nm/598nm)を持つ新規蛍光色素、TokyoMagentaの開発にこれまでに成功しています。TokyoMagentaは、高い水溶性、高い蛍光輝度など蛍光試薬に利用するための多くの長所を持っています。
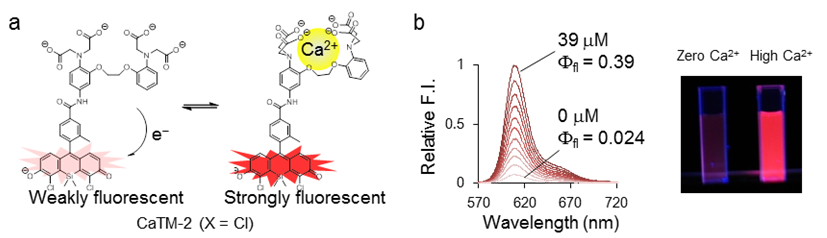
図2 赤く光る新しいカルシウム蛍光試薬
(a)今回開発に成功した赤く光るカルシウム蛍光試薬の分子構造。(b)カルシウム蛍光試薬を含んだ溶液中でのカルシウムイオンの濃度変化に伴う蛍光スペクトル変化。カルシウムイオン濃度の上昇に伴い、蛍光試薬由来の609nmの赤い蛍光の上昇が観察される。
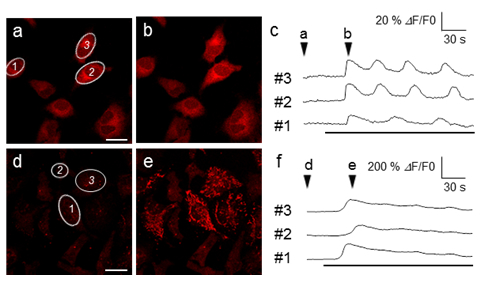
図3 ヒスタミン刺激による細胞内カルシウムイオン濃度変動の画像化
(a-c)CaTM-2 AMをHeLa細胞に導入し、ヒスタミン刺激を行った時の蛍光像(a、b)および、(a)内に1~3で示した各細胞における蛍光強度の時間変化(c)。CaTM-2が細胞質に分布し、カルシウムイオン濃度の変動をとらえていることが観察される。
(d-f)既存の赤色蛍光試薬であるRhod-2 AMを用いて、(a-c)と同じ実験を行った時の画像。Rhod-2がミトコンドリアに局在する性質があるので、ミトコンドリアでのカルシウムイオン濃度の変動をとらえていることが観察される。
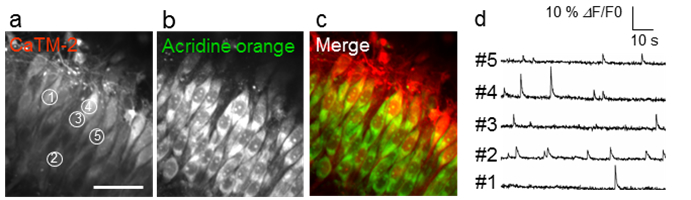
図4 ラット脳スライス切片における神経細胞の自然発火の画像化
(a-c)CaTM-2の蛍光像(a)、細胞体を同定するために用いたアクリジンオレンジの蛍光像(b)および、重ね合わせた蛍光像(c)。(d)CaTM-2の蛍光強度の時間変化。(a)内に示した①~⑤の位置において、神経細胞の発火に伴う細胞内カルシウムイオン濃度の変動を蛍光強度の変化としてとらえることに成功している
<用語解説>
- 注1) 蛍光試薬
- ここでいう蛍光試薬とは、対象となる分子種と反応もしくは結合することで、励起波長、蛍光波長、蛍光強度などの蛍光特性が変化する機能性分子のこと。
- 今回開発したカルシウム蛍光試薬である『CaTM-2』を生体組織や細胞内へと導入し、蛍光顕微鏡下で蛍光強度の変化を測定することで、細胞内のカルシウムイオンの濃度変動を解析することができる。
- 注2) マルチカラーイメージング
- 複数の蛍光色素または蛍光たんぱく質を用いて、同時に異なる生体分子(細胞種)の挙動を蛍光顕微鏡によって観察する技術のこと。
- 注3) セカンドメッセンジャー
- 神経伝達物質などの細胞外の情報伝達物質が細胞膜に存在する受容体と結合することによって、細胞内で新たに生成する別の情報伝達物質のことをいう。カルシウムイオンは、細胞膜受容体が刺激を受けることにより細胞外から細胞内へと直接流入することがあるので、セカンドメッセンジャーとして扱われる。
<論文名>
“Red Fluorescent Probe for Monitoring Dynamics of Cytoplasmic Calcium Ions”
(細胞質内カルシウムイオンの濃度変動を可視化する赤色蛍光プローブの開発)
doi: 10.1002/anie.201210279
<お問い合わせ先>
<開発内容に関すること>
花岡 健二郎(ハナオカ ケンジロウ)
東京大学 大学院薬学系研究科 准教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4852 Fax:03-5841-4855
E-mail:
<JSTの事業に関すること>
久保 亮(クボ アキラ)、菅原 理絵(スガワラ マサエ)
科学技術振興機構 産学基礎基盤推進部 先端計測室
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3529 Fax:03-5214-8496
E-mail:
ホームページURL:https://www.jst.go.jp/sentan/