ポイント
- 過剰な免疫反応を抑制する制御性T細胞(Treg)が作られる仕組みは謎だった。
- Nr4aたんぱく質を適度に活性化すると、Tregが作られることを発見。
- 関節リウマチなどの自己免疫疾患や花粉症、ぜんそくなどのアレルギー性疾患の新しい治療法に期待。
JST 課題達成型基礎研究の一環として、慶應義塾大学 医学部の関谷 高史 助教、吉村 昭彦 教授らは、マウスの実験で自己免疫疾患の発症と抑制に関係する基本的で重要な免疫調節メカニズムを発見しました。
関節リウマチや炎症性腸疾患などの自己免疫疾患注1)や、花粉症、ぜんそくなどのアレルギー性疾患は、過剰な免疫反応が原因となって発症すると考えられています。炎症性腸疾患は近年患者数が毎年1万人近く増加しており、花粉症は今や5人に1人が罹患する国民病です。このような免疫反応を推進する細胞がいる一方、免疫反応を抑制する細胞の制御性T細胞(Treg)注2)が存在します。通常はTregが過剰な免疫反応を抑制することで免疫疾患が起こらないようにしていると考えられています。そのため、Tregを増やすことで免疫疾患を治療できると考えられてきましたが、これまでTregがどのようなメカニズムで生み出されるのかは全く不明でした。
今回、本研究グループは核内受容体注3)の一種、Nr4aというたんぱく質がTregの生産に必須であることを発見し、さらにNr4aを適度(強すぎず、弱すぎず)に活性化することで通常はTregにならない細胞もTregにすることができることをマウスの実験で示しました。
今後、Nr4aを人為的に活性化させる仕組みをさらに明らかにすることで、Tregの量が調整可能になると考えられます。本研究成果は将来的に、関節リウマチや炎症性腸疾患などの自己免疫疾患や花粉症、ぜんそくなどのアレルギー性疾患に対する新しい治療方法の開発、あるいは臓器移植時の拒絶反応の制御につながるものと期待されます。
本研究成果は、2013年1月20日(英国時間)に英国科学雑誌「Nature Immunology」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立病院機構 理事長) |
| 研究課題名 |
「細胞内シグナル制御による免疫リプログラミング」 |
| 研究代表者 |
吉村 昭彦(慶應義塾大学 医学部 微生物学・免疫学教室 教授) |
| 研究期間 |
平成20年10月~平成26年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、細胞内のシグナル伝達制御機構の解明とその人為的な調節により新たな免疫疾患治療の方法論を開発することを目指しています。
<研究の背景>
免疫システムは我々の身体を多種多様な病原体から守っています。病原体は、細菌・ウイルス・寄生虫・真菌、さらにその中にも数限りない種類が存在します。それら異なった種類の病原体を排除するために、生体は炎症などを伴う適切な免疫反応を作動させますが、その司令塔としての役割を果たしているのがヘルパーT細胞(CD4陽性T細胞注4))です。ヘルパーT細胞は胸腺で生まれ、胸腺の外(末梢)に出て身体を循環し、身体に侵入した病原体の種類に応じてTh1、Th2、Th17の3種類のいずれかの炎症を引き起こすエフェクターT細胞注5)に分化し、それぞれの病原体の排除に最適な免疫反応を誘導します(図1)。一方、免疫反応は適切な時期に終息しなければなりません。また、自己のたんぱく質や食物には反応してはいけません。もし異常に免疫系が活性化され続けたり、自己のたんぱく質や食物や花粉などの無害な物質と反応すると、関節リウマチや炎症性腸疾患などの自己免疫疾患や花粉症などのアレルギーを引き起こします。そこで、ヘルパーT細胞のなかにはエフェクターT細胞を抑制し免疫反応を適切に制御するT細胞、制御性T細胞(Treg)が存在します。Tregはさまざまなメカニズムで免疫反応を抑制し、生体の恒常性(ホメオスターシス)を維持しています。Tregの異常は自己免疫疾患や花粉症、ぜんそくなどのアレルギー性疾患を引き起こします。逆にTregを人為的に増強できればそれら疾患の治療に結びつくと考えられます。また臓器移植の拒絶反応にもエフェクターT細胞が寄与しており、Tregの増強は臓器移植の拒絶反応の抑制にも効果的であると考えられています。しかしTregそのものがどのように発生するのかは長らく不明で、Treg発生のメカニズムの解明は現代免疫学における大きな課題の1つでした。
<さらに詳細な背景>
ヘルパーT細胞は、胸腺で前駆細胞から発生・分化を遂げますが、この過程で抗原を感知するT細胞受容体(TCR)注6)がランダムな遺伝子組み換えによって数千万種類も形成され、外からのさまざまな病原体の排除に備えます。T細胞を増やしたり生存させたりするためには、外からの抗原がない状態でもTCRが適度の刺激を受ける必要があります。このため胸腺では、抗原提示細胞注7)に提示された自己抗原(主に自己細胞のたんぱく質)がTCRを弱く刺激します。この結果おのおののT細胞が異なったTCRを持って、さまざまな抗原の排除に対応できる免疫システムを構築できるようになります。しかし、ランダムな遺伝子組み換えによってさまざまなTCRを形成するので、当然自分自身の細胞が持つたんぱく質を抗原と認識して強く反応するTCRを持つT細胞が発生する可能性があります。胸腺での発生過程では、これらの自己抗原に対して強い反応を起こすT細胞は強いTCR刺激が入り、アポトーシス(細胞死)注8)と呼ばれる機構によって死亡し除去されます。この現象をネガティブセレクションと呼びます(図2)。さらに、それよりは少し弱いが自己抗原をある程度強く認識するTCRを持つT細胞が死なずにTregになるのだろうと考えられています(図2、Treg)。それよりもさらに弱く自己抗原を認識するT細胞が、病原体排除に機能する一般的なT細胞(ナイーブT細胞注9))として胸腺の外に出て末梢を循環します(図2、ナイーブT細胞)。この一般的なT細胞が末梢で抗原に出会うと先に述べたエフェクターT細胞になります。また、自己抗原を全く認識できない細胞はアポトーシスが誘導され死滅(図2、細胞死)します。このように、胸腺においてヘルパーT細胞は、主に自己抗原に対する親和性(反応性)によりその運命を決定づけられます。この仕組みが免疫システムの暴走を防ぎ、恒常性を維持する基盤となります。しかし、このプロセスを制御する分子メカニズムは多くが未解明で、人為的にコントロールすることも不可能でした。
<研究の経緯>
本研究グループは、これまでの研究で核内受容体ファミリーに属するNr4a2というたんぱく質がTregの性質を決める重要な転写因子であるFoxp3注10)の発現を誘導する能力があることを見いだし、報告を行いました(図3)(参考文献)。さらに、Nr4a2やその仲間はTCRの活性化によって多く生産される分子であることから、Nr4a2が胸腺でのT細胞の運命決定、特にTregを生み出す鍵となる分子であると考え、その役割の解明を進めることにしました。
<研究の内容>
本研究グループはNr4a2の役割を解明するために、まずマウスのNr4a2のみを欠損させたところ、免疫反応が促進されるものの、胸腺でTregは正常に発生し、さらにそのマウスは自己免疫疾患を発症しませんでした。そこで、Nr4a2には、Nr4a1、Nr4a3という良く似た仲間(ファミリー分子)が存在することに着目し、この仲間が互いに同様の機能を持ってその機能を補い合っていると考え、Nr4a1、Nr4a2、Nr4a3全てをT細胞から欠損させたマウス(Nr4a-TKOマウス:Nr4a triple knockout mouse)を作製し、解析を行いました。
解析の結果、予想通り、Nr4a-TKOマウスでは胸腺・末梢ともにTregがほぼ完全に存在しないことが明らかとなりました(図4A)。その結果、Nr4a-TKOマウスは激しい全身性の自己免疫疾患を発症し、生後3週間以内に死亡することが明らかとなりました(図4B)。従って、Nr4aファミリー分子がTregの発生に必須であることが証明されました。またNr4a-TKOマウスの症状は、過去の文献との比較により、Tregのみを欠損しているマウスよりも重篤であり、さまざまな解析の結果からもTregの分化異常に加えて、ネガティブセレクションの異常が関与している可能性が強く考えられました。さらに解析を重ねたところ、Nr4a1、Nr4a2、Nr4a3は同様の機能を持ち、互いに補い合ってTregの分化とネガティブセレクションに機能していることが明らかとなりました。
次に、Nr4aがヘルパーT細胞の運命決定を担う因子であると考え、その検証を試みました。実験にはOT-IIと呼ばれるTCRを持つT細胞を用いました。マウスの胸腺内にはOT-II TCRと強く結合する自己抗原が存在しないため、OT-II TCRを持つT細胞はTregに分化するために必要なTCRの刺激を受けることができず、OT-II TCRを持つTregは存在しないことが明らかとなっています。そこで、このOT-II TCRを持つヘルパーT細胞に、遺伝子操作によって任意の強さで人工的に活性化させたNr4aを作用させ、ヘルパーT細胞の運命がどのように決定されるかを解析しました。その結果Nr4aを強力に活性化させるとOT-II TCRを持つヘルパーT細胞にアポトーシス(細胞死・ネガティブセレクション)が誘導され、中程度の活性化を起こすとTregが誘導されることを見いだしました(図5)。このことは、TCRと自己抗原との親和性が強い時は、Nr4aも強く活性化され、アポトーシス誘導遺伝子の発現が誘導されてネガティブセレクションへ、TCRと自己抗原との親和性が中程度の時は、Foxp3の発現が誘導されTregへとヘルパーT細胞の運命が決定づけられていることが分かりました(図6)。
以上の研究により、胸腺におけるヘルパーT細胞の発生において、Nr4aがヘルパーT細胞と自己抗原との親和性とヘルパー細胞の運命決定を結ぶ鍵となるたんぱく質であることを証明しました。また、Nr4aを強度に活性化するとネガティブセレクションが、Nr4aを中程度に活性化することによって普通はTregにならないT細胞から人為的にTregが作られることを示しました。
<今後の展開>
本研究によって、Nr4aはヘルパーT細胞の運命決定を担う鍵となり、Tregを作る重要な役割を果たす因子であり、自己免疫疾患の抑制において中心的な役割を担っていることが明らかとなりました。このたんぱく質の活性化によって、免疫反応を抑制するTreg細胞を人為的に誘導することも可能になると考えられます。特にNr4aは核内受容体と呼ばれる分子の性質を持っており、活性化させる低分子化合物(リガンド)の存在も予想されます。今後さらなる研究からNr4aの活性化による自己免疫疾患、アレルギー疾患などの新規治療法の樹立が可能になると期待されます。また臓器移植の際の拒絶反応抑制法の開発も期待できます。さらに、ヒトの炎症性疾患とNr4a遺伝子異常の関連性も明らかにされることで、免疫難病の発症の仕組みが解明されることが期待されます。
<参考図>
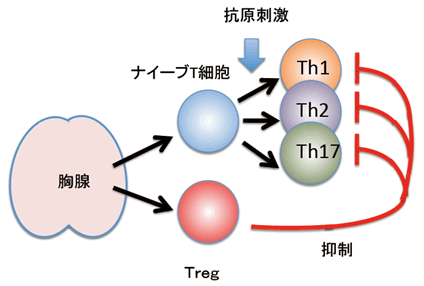
図1 ヘルパー(CD4陽性)T細胞の分化とTregによるエフェクターT細胞の抑制
ヘルパーT細胞は胸腺で生まれナイーブT細胞やTregとして胸腺の外に放出されます。侵入した病原体の種類に応じてナイーブT細胞は3種類いずれかのエフェクターT細胞(Th1、Th2、Th17)に分化し、その病原体の排除に最適な免疫応答を誘導します。一方TregはそれらエフェクターT細胞を抑制する機能を持ちます。
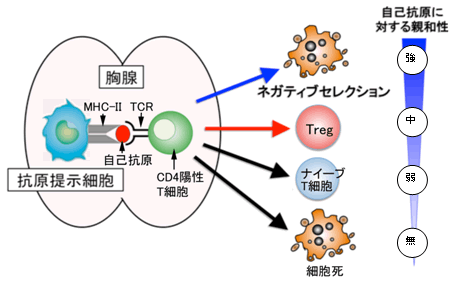
図2 胸腺におけるヘルパー(CD4陽性)T細胞発生の分化
胸腺の抗原提示細胞が提示する自己抗原(MHC-IIに結合している)に対する親和性が細胞の運命決定の主因となります。
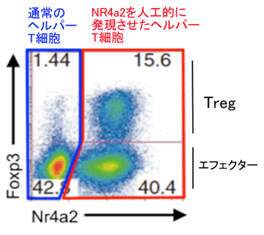
図3 Nr4a2強制発現によるTreg主要転写因子Foxp3の誘導
Nr4a2を人工的に発現させたヘルパー(CD4陽性)T細胞(赤枠)のみ、Tregのマーカーといえる転写因子Foxp3の強い発現誘導が見られます(参考文献)。
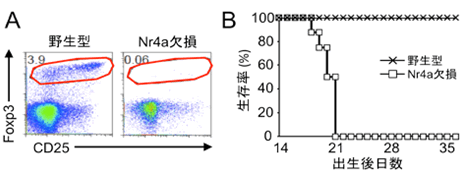
図4 Nr4a欠損マウスの解析
(A)Nr4a欠損マウスではTreg(赤枠で示した画分)がほぼ全く見られない。
(対照マウス:野生型ではTregが見られる。)
(B)Nr4a欠損マウスは全身性の自己免疫疾患により生後3週間以内に死亡する。
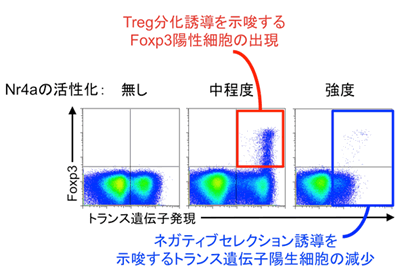
図5 Nr4aはCD4陽性T細胞の自己抗原に対する親和性と
運命決定を結ぶキーファクターとして機能する。
OT-II TCRを持つ胸腺のヘルパー(CD4陽性)T細胞はNr4aの活性化強度に従って、中程度の活性化時にはTregへの分化(真ん中)、強度の活性化時にはネガティブセレクション(右側)の誘導を示唆する挙動を示した。この実験系ではトランス遺伝子陽生細胞(カラム右半分)でNr4aの活性調節が可能となっている。
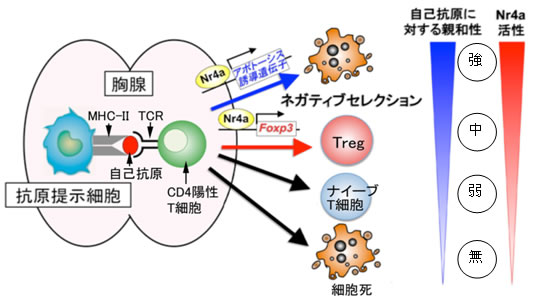
図6 胸腺ヘルパーT細胞運命決定におけるNr4a機能のモデル図
T細胞のMHC-II自己抗原複合体に対する親和性の強度に従って、発現誘導を受けたNr4aは、Foxp3やアポトーシス誘導遺伝子の発現誘導により、それぞれTreg分化とネガティブセレクションを誘導する。
<用語解説>
- 注1) 関節リウマチや炎症性腸疾患などの自己免疫疾患
- 自己免疫疾患とは、免疫系が自分自身の正常な細胞や組織に対して過剰に反応し、攻撃を加えることにより発症する疾患の総称である。関節リウマチでは手足の関節、炎症性腸疾患では腸管壁で過剰な免疫反応が起こり、炎症が生じる。国内患者数は70万人と言われている。炎症性腸疾患の患者数は著明な増加傾向にあり、国内患者数は潰瘍性大腸炎とクローン病をあわせて15万人を超している。
- 注2) 制御性T細胞(Treg:ティーレグ)
- CD4陽性ヘルパーT細胞の一種で、免疫抑制機能を持つ。自己に対する免疫応答を抑制するほか、IL-10やTGFβなどの抗炎症性サイトカインを分泌し、過剰な炎症を抑制する機能も持つ。主に胸腺で作られ、免疫システムの負の制御において中心的な役割を担っており、その分化や機能発現の異常は自己免疫疾患やアレルギーをはじめさまざまな免疫疾患の引き金となる。
- 注3) 核内受容体
- DNAの転写を調節するたんぱく質、いわゆる転写因子の一種であるが、ホルモンなどのリガンドにより活性調節を受けるドメインを分子内に持つ。ヒトでは48種類の核内受容体が存在し、スーパーファミリーを形成する。エストロゲン受容体やビタミンD受容体もこれに属し、それぞれ女性ホルモンとビタミンDにより活性化を受ける。Nr4aもこのファミリーに属する。
- 注4) CD4陽性T細胞
- CD4たんぱく質を細胞表面に発現するT細胞。細胞障害性T細胞の機能発現の誘導、B細胞の分化成熟や抗体産生の誘導、貪食細胞の活性化を誘導し免疫応答を正に制御するエフェクターT細胞と、免疫応答を負に制御する制御性T細胞に大別される。
- 注5) エフェクターT細胞
- 免疫系を活性化するT細胞。特にヘルパーT細胞ではTh1、Th2、Th17の3種類が知られている。それぞれインターフェロンγ(IFNγ)やインターロイキン17(IL-17)など特徴的なサイトカインを放出し、感染防御や免疫応答に関わるほか、自己免疫疾患、アレルギー、がんでも重要な働きをする。
- 注6) T細胞受容体(TCR:T cell receptor)
- T細胞表面に発現している分子であり、MHC-抗原複合体を認識する。ヘルパーT細胞が発現するTCRはMHC-IIに掲示された抗原を認識する。末梢において、T細胞受容体は下流にシグナルを伝え、T細胞の機能発現や増殖が誘導されエフェクターへと成熟させる。胸腺においてはT細胞受容体からのシグナル伝達は、T細胞発生分化の運命決定を担う。
- 注7) 抗原提示細胞
- 樹状細胞、マクロファージ、B細胞、胸腺上皮細胞など。ヘルパーT細胞に抗原を提示する機能を持つたんぱく質を主要組織適合性抗原クラスII(MHC-II:major histocompatibility antigen class II)と呼ぶ。抗原提示細胞の細胞表面にあって、抗原と結合してTCRを刺激する。胸腺では自己たんぱく質の一部を提示し、末梢においては主に病原体などの外来の抗原を提示する。
- 注8) アポトーシス(細胞死)
- 外傷性ストレスで起こる細胞死でなく、細胞内に備わる分子機構により誘導される、管理・調節された細胞死。
- 注9) ナイーブT細胞
- T細胞は胸腺においては自己抗原を弱く認識して生存シグナルを受け発達し胸腺の外に出た段階でナイーブT細胞と呼ばれる。胸腺の外に出るとナイーブCD4陽性T細胞は病原体などの抗原を認識し、病原体の種類や周囲の環境に応じて、Th1、Th2、Th17として知られるエフェクターT細胞へと分化誘導され、最適の免疫応答を引き起こす。
- 注10) Foxp3(フォックス ピー スリー)
- Tregの分化・機能発現・分化状態の維持全てにおいて必須の役割を担う転写因子。発現はTregにほぼ特異的であるため、Tregを同定する際のマーカー分子としても用いられる。免疫抑制機能を持つたんぱく質の発現を誘導し、一方で炎症に関わるたんぱく質の発現を抑制する。
<論文名>
“Nr4a receptors are essential for thymic regulatory T cell development and immune homeostasis”
(Nr4a受容体は胸腺におけるTregの発生と免疫恒常性の維持に必須である)
doi: 10.1038/ni.2520
<参考文献1>
Sekiya, T. et al. “The nuclear orphan receptor Nr4a2 induces Foxp3 and regulates differentiation of CD4+ T cells.”,Nat Commun 2, 269 (2011).
<お問い合わせ先>
<研究に関すること>
関谷 高史(セキヤ タカシ)
慶應義塾大学 医学部 微生物学・免疫学教室 助教
吉村 昭彦(ヨシムラ アキヒコ)
慶應義塾大学 医学部 微生物学・免疫学教室 教授
〒160-8582 東京都新宿区信濃町35 東校舎4F
Tel:03-5363-3483 Fax:03-5360-1508
E-mail:
<JSTの事業に関すること>
石正 茂(イシマサ シゲル)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: