 骨表面に引っ付いて骨を壊している破骨細胞のライブイメージング
骨表面に引っ付いて骨を壊している破骨細胞のライブイメージング
大阪大学 免疫学フロンティア研究センターの石井 優 教授らの研究グループは、生きたままで骨の内部を観察することに成功し、破骨細胞が実際に骨を壊していく様子を、リアルタイムで可視化することに成功しました。この可視化により、「骨の表面にヒルのように強力に貼りついて骨を壊している破骨細胞(R型と命名)」と、「骨の表面でアメーバのように動き回っていて骨を壊していない破骨細胞(N型と命名)」の2種類の細胞が存在し、破骨細胞はR型とN型を短い時間で遷移していることも分かりました。さらに、骨粗鬆症などの状態では、破骨細胞の総数だけでなく、R型の数が増えていることや、治療薬(ビスホスホネート製剤)を投与すると、破骨細胞の総数が減るだけでなく、N型が増えることで骨の破壊が抑えられることが分かりました。さらに、関節リウマチなどの骨破壊に関与すると言われていたTh17という炎症性T細胞は、骨の表面で破骨細胞に接触し、N型をR型へと変換させることで骨の破壊を引き起こすことが、実際のライブイメージングで解明できました。
実は破骨細胞には骨を壊す働きだけではなく、骨芽細胞という骨を修復する細胞を活性化する作用もあり、現在の治療薬で破骨細胞の総数を減らすと骨の修復ができなくなり、逆に骨が脆くなってしまうことが大きな問題点となっています。今回成功したライブイメージング系は、破骨細胞の総数は減らさずに、R型からN型に変化させる理想的な薬を今後開発していく上で、極めて重要な研究成果であると考えます。
本研究成果は、2013年1月16日(アメリカ東部時間)に米国臨床医学雑誌「ジャーナル・オブ・クリニカル・インベスティゲーション」オンライン版に掲載されます。また本研究は、独立行政法人 科学技術振興機構(JST)戦略的創造研究推進事業 チーム型研究(CREST)「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」研究領域における研究課題「次世代の生体イメージングによる慢性炎症マクロファージの機能的解明」、および文部科学省新学術領域研究「蛍光生体イメージ」領域における研究課題「骨の生体イメージングによる骨髄細胞・骨転移癌の遊走・分化やニッチ環境の可視化」の支援を受けて行われたものです。
<研究の背景>
骨粗鬆症や関節リウマチ、がんの骨転移などの病気では、骨が異常に壊されていくことが大きな問題です。これらの病態で骨を壊している細胞が、「破骨細胞」と呼ばれる、骨を壊すために特殊に分化したマクロファージです。
これまでの骨の研究では、骨を取り出してナイフなどで薄く切ってから、顕微鏡で観察していました。この方法でも骨が壊されている部位に多数の破骨細胞が集まっている様子は観察されていましたが、それらが実際にどうやって骨を壊しているのかについては明らかになっていませんでした。取り出して薄く切った骨の組織の中では、破骨細胞の形は残っていますが、すでに死んでいますので動きは見ることはできません(図1)。
また、容器内(in vitro)でマクロファージを特殊な環境下で培養すると、大型の「破骨細胞様」の細胞ができ、これまでの多くの破骨細胞の研究がこの細胞を用いて行われてきましたが(図2)、この細胞が実際に生体内にいる破骨細胞と同じであるという証拠はなく、私たちの体の中で破骨細胞がどのように骨を壊しているかについては不明なままでありました。
大阪大学 免疫学フロンティア研究センター 細胞動態学教室の石井 優 教授らの研究グループでは、2光子励起顕微鏡という特殊な装置を使って、様々な組織を「殺さずに生きたままで」観察する方法をこれまでに次々と立ち上げてきました。骨の内部についても、すでに可視化する系を立ち上げておりましたが(Nature誌(2009)などに報告)、その解像度は十分ではなく、骨の中に細胞が出たり入ったりすることを観察することができる程度でありました(図3)。
今回、石井教授らは、イメージング系をさらに改良し、また特殊な蛍光標識技術を活用することで、骨の表面で骨を破壊・吸収する破骨細胞の動きを鮮明に捉えることに世界で初めて成功しました。後に詳しく述べますが、この方法により、「骨の表面で実際に骨を壊している破骨細胞(R型)」と、「骨の表面にいるが骨を壊していない破骨細胞(N型)」の2種類の細胞が存在することが分かりました。この2つの破骨細胞を区別できるようになったことは、今後の治療薬開発の上で非常に重要であります。それは、以前より、破骨細胞には骨を壊す働きだけではなく、骨芽細胞という骨を修復する細胞を活性化して、骨の修復を促す作用もあることが知られており、治療の際には、破骨細胞の数を減らしすぎると骨の修復ができなくなり、逆に骨が脆くなってしまうことが大きな問題となっているからです。今回、破骨細胞にも、実際に骨を壊しているもの(R型)とそうでないもの(N型)が存在することが明らかになったため、今後の治療としては、破骨細胞の総数を減らすのではなく、R型を減らしてN型を増やすことを目指すべきであることが明らかになり、これは今後の骨破壊治療薬の臨床開発にとって極めて重要で意義の大きな知見であると言えます。
<研究の内容>
・破骨細胞が骨を壊す様子を可視化することに世界で初めて成功:破骨細胞には、実際に骨を壊しているもの(R型)と、今は壊していないもの(N型)の2種類が存在することが分かる
破骨細胞が骨の表面でどのようにして骨を壊しているのかをライブイメージングで可視化するために、石井教授らは破骨細胞が骨を壊すときに用いる「プロトンポンプ(=強い酸を細胞外へ放出する装置)」にGFP(緑色蛍光タンパク質)で標識した蛍光リポーターマウスを作成しました。さらに、骨のライブイメージングシステムを改良し、骨の表面を高い解像度で解析できるようにした結果、骨の表面で骨を破壊している破骨細胞の動態を捉えることに世界で初めて成功しました(図4、動画参照)。
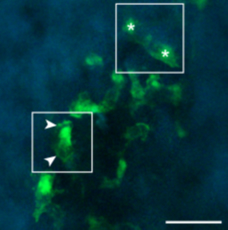
この動画を見ると、様々な複雑な形をした破骨細胞が骨の表面にへばりついている様子が観察されます。さらによく見ると、ヒルのように骨に密着して動きの少ないもの(図4、左下)と、アメーバのように動き回っているもの(図4、右上)の2種類が存在することが分かりました。密着して動かない細胞は、密着面に沿ってプロトンポンプ(緑色のシグナル)が存在しているため(図4、左下の矢印)、これはいままさに骨に向かって酸を出して骨を壊している細胞であると考えられました(「壊す=resorbing」から“R型”と名付けました)。一方で、右上のアメーバ運動をしている細胞は、プロトンポンプが膜表面になく、細胞内に取り込まれていることから(図4、右上のアスタリスク)、いまは骨を壊していないもの(non-resorbingより“N型”としました)と考えられました。つまり、この方法で、破骨細胞の数だけでなく、実際にどれがいま骨を壊していて、どれは働いていないか(壊していないか)が、はっきりと区別できるようになりました。
またしばらくの間、イメージングで細胞の動きを追いかけていると、数十分くらいの間に、R型であったものがN型に変わったり、逆にN型からR型になったりするものが見られました。これらのデータから、破骨細胞は骨の表面でR型とN型を繰り返して、つまり、骨を壊したり、お休みしたりしながら過ごしていることが分かりました。
・骨の病気では、破骨細胞の数だけでなく、R型とN型の割合も大きく変化している
次に、骨の病気の際に、その内部のライブイメージング画像がどのように変化するか見てみました。
まずは、薬剤で破骨細胞を活性化させて、骨粗鬆症を人為的に誘導したときに骨の様子ですが(図5、動画参照)、破骨細胞の数がかなり増えていることが分かりますが、単に数が増えるだけでなく、そのほとんどがR型となっていて、骨を壊していることが分かります(図5の矢印)。一方で、この骨粗鬆症の状態を、現在汎用されている骨粗鬆症治療薬であるビスホスホネート製剤で治療した状態の骨をライブイメージングで観察してみると(図6、動画参照)、破骨細胞の絶対数が激減しますが、それだけでなく、残っている細胞もN型が多く、骨を壊していないことが分かります(図6のアスタリスク)。このように、骨の破壊がどうなっているかを考える上では、細胞の数だけではなく、その数のうちどれだけがR型(機能型)かN型(非機能型)かを評価することが重要であることが分かります。これは考えてみると当たり前ですが、私たちの職場も、ただ人数が多ければ仕事が進むというものではなく、そのうちのどれだけが「機能的」であるかが大事です。破骨細胞の世界も同じです。こういったイメージング技術革新によって、どれだけが「機能的」なのかを区別することができるようになったことは大きな進歩であると言えます。
・炎症性のT細胞であるTh17は、N型の破骨細胞に働きかけてR型へと変化させることによって骨の破壊を誘導する
少し複雑な話になりますが、関節リウマチでは炎症が起こった関節では、関節が腫れるだけではなく、骨が壊れていきますが、このときに骨を壊しているのも破骨細胞です。ただ、このときに誰が破骨細胞に「骨を壊せ」という指令を出しているのかは不明でありました。関節リウマチなどの自己免疫疾患の発症や増悪に重要な役割を担う、炎症性のT細胞であるTh17という細胞が、骨の破壊にも関わるのではないかと予想されていましたが、具体的なメカニズムは全く不明でありました。
石井教授らのグループは、このライブイメージング系を利用して、生体内でのTh17と破骨細胞の関係を可視化することにしました。その結果、Th17がN型の破骨細胞と接触することにより、R型へと変化させることで骨の破壊を誘導していることが分かりました(図7、および会見で紹介する動画参照)。つまり、働いていない(=骨を壊していない)破骨細胞の頭を叩いて回って、骨を壊すように指示を出していることが分かりました。
これは、関節リウマチで骨が壊れていくメカニズムの本質を捉えたものであり、関節リウマチで骨の破壊を抑える治療法を検討していく上で、重要な知見であると考えられます。
<今後の展開>
「よい骨疾患治療薬とは何か?」
日本全体で1,200万人以上(先進国全体では6,000万人以上)の患者が存在すると言われている骨粗鬆症は、もはや日本に限らず先進国高齢社会の大きな社会問題であります。この大きなマーケットをめがけて様々な骨疾患治療薬が開発されていますが、そもそも「よい薬とは何か」という最も重要な点が意外と明瞭ではありません。
これまでビスホスホネート製剤を始めとして、行き過ぎた破骨細胞の働きを抑えるために、「破骨細胞を殺す(=数を減らす)」薬剤が主に使用されてきました。今回のデータでも、ビスホスホネート製剤は確かに骨表面での破骨細胞の絶対数を大きく減らすことが分かりました(図6)。しかし一方では、破骨細胞は、骨を修復する細胞である骨芽細胞に働きかけて、その分化・機能(骨再生)を促すことが知られており、破骨細胞を減らしすぎると逆に骨が脆くなってしまうのでよくないとされています(顎骨壊死などの重篤な副作用もこれに起因するかもしれません)。
そういった観点から、「よい治療薬」とは、破骨細胞の絶対数を減らすのではなく、R型を減らして、逆にN型を増やすような薬である、と言えると思います。今回の研究成果によって、今まででは評価することができなかった、「破骨細胞の骨破壊機能」を見ることができるようになったため、これを指標とした新たな創薬開発が可能となると思われます。実際に、石井教授らは、既存の治療薬、および現在開発中の薬剤をこの新しいイメージング系で評価することで、「総数は減らさないが、R型を減らしてN型を増やす」といった、理想的なプロファイルに近いものを見つけております。こういった新しいコンセプトによる次世代の骨疾患治療薬が、現代社会の大きな悩みである骨粗鬆症の克服に向けて大きく貢献できることを祈念して止みません。
<参考図>
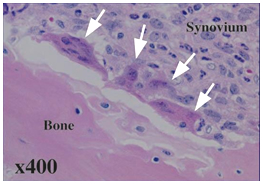
図1 骨破壊の組織像
骨(bone)の表面に多くの破骨細胞がへばりついている様子が観察される(白色矢印)が、これが実際にどのように機能しているかは不明であった。
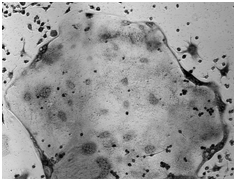
図2 培養容器内で出現した「破骨細胞様」の細胞
真ん中の巨大な細胞が破骨細胞様細胞であるが、周囲の小型のマクロファージに比べて異常に大きい。時には直径が1mmにも到達することもあり、これが生体内の破骨細胞と同一のものかは実際にはかなり疑わしい。
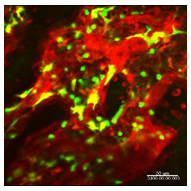
図3 以前の骨組織のイメージング画像
個々の細胞は緑色のスポットとして描出されている。細胞の大きな動きは解析できるが、細かい機能(骨破壊など)の観察は困難であった。
図4 骨表面に引っ付いて骨を壊している破骨細胞のライブイメージング
左下の細胞は骨に密着して動きが少なく、いままさに骨を壊しているもの(R型)で、右上の細胞は骨表面上で移動していて、いまは骨を壊していない(N型)。このイメージングでは各細胞の細かい動き、形・機能の変化を追うことができる。
図5 骨粗鬆症を誘導したときの骨の内部のライブイメージング
破骨細胞の絶対数が増えているだけでなく、そのほとんどが、骨破壊を行っているR型となっていることに注目したい。
図6 骨粗鬆症治療薬(ビスホスホネート製剤)で治療したときの骨の内部のライブイメージング
破骨細胞の数が減っており、生き残っているものの骨破壊をしていないN型となっている。
図7 N型の破骨細胞にTh17が接触し、R型へと変化していく過程のライブイメージング
Th17との接触の前後で、破骨細胞の形態変化に差がある(N型→R型)が観察される。
<掲載論文名>
“Dynamic visualization of RANKL and Th17-mediated osteoclast function”
(RANKLやTh17による破骨細胞機能の動的可視化)
米国臨床医学雑誌(The Journal of Clinical Investigation)
doi: 10.1172/JCI65054
<お問い合わせ先>
<研究内容に関すること>
石井 優 (イシイ マサル) 教授
国立大学法人 大阪大学 免疫学フロンティア研究センター(WPI-IFReC) 細胞動態学研究室
Tel:06-6879-4267(直通)または06-6879-4268(研究室) Fax:06-6879-8296
E-mail:
<JSTの事業に関すること>
石正 茂 (イシマサ シゲル)
独立行政法人 科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
