ポイント
- 炎症性腸疾患は、原因不明の難治性疾患で近年患者数が増加(国内10万人以上)。
- 免疫細胞の1つである肥満細胞の活性化が炎症性腸疾患の悪化を引き起こす。
- 肥満細胞と細胞外ATPとの結合を阻害することで炎症を抑制。新規治療法に道。
JST 課題達成型基礎研究の一環として、東京大学 医科学研究所の倉島 洋介 日本学術振興会 特別研究員、國澤 純 准教授、清野 宏 教授らの研究グループは、免疫異常により慢性の腸炎を起こす「炎症性腸疾患注1)」を悪化させる分子機構の1つを明らかにしました。
炎症性腸疾患は、近年増えている原因不明の難治性疾患であり、20歳代から40歳代を中心として、国内だけで10万人以上が罹患しています。1970年代に、炎症性腸疾患の患者の腸管組織では、免疫細胞の1つである肥満細胞注2)が活性化していることが報告されました。肥満細胞は、花粉症や食物アレルギーを引き起こす免疫反応の「悪玉」として働く一方で、感染症から生体を守る「善玉」として働くなど多様な役割を担うことが知られています。しかし、これまで炎症性腸疾患における肥満細胞の役割は不明でした。
本研究グループははじめに、肥満細胞を欠損させたマウスでは、炎症性腸疾患の症状が軽減していることを明らかにしました。このことから、肥満細胞は炎症性腸疾患では「悪玉」として働くことが分かりました。また、これまでの報告の通り、炎症性腸疾患を発症しているマウスの腸管では、肥満細胞が異常に活性化していることから、何が肥満細胞を活性化しているのかを探索したところ、従来のアレルギー反応での働きとは異なる、新たな肥満細胞の活性化機構が明らかとなりました。そのメカニズムとは、腸内細菌や傷害を受けた組織などから細胞外に放出されたアデノシン三リン酸(ATP)注3)が、肥満細胞の表面にあるP2X7たんぱく質(受容体)と結合することで、肥満細胞を活性化することであることが本研究グループによって初めて証明されました。
P2X7たんぱく質を欠損させた肥満細胞を持つマウスでは、炎症性腸疾患の症状が抑えられることから、P2X7たんぱく質と細胞外ATPの結合を抑えることが、新たな炎症性腸疾患の治療標的として期待されます。
本研究は、東京大学 医科学研究所の伊庭 英夫 教授、大阪大学の飯島 英樹 講師、東京理科大学 理研免疫・アレルギー科学総合研究センターの久保 允人 教授らの協力を得て行いました。本研究成果は、2012年9月4日(英国時間)発行の英国科学雑誌「Nature Communications」のオンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」
(研究総括:宮坂 昌之 大阪大学 未来戦略機構 特任教授) |
| 研究課題名 |
「炎症性腸疾患の慢性化制御機構の解明と治療戦略の基盤構築」 |
| 研究代表者 |
清野 宏(東京大学 医科学研究所 教授) |
| 研究期間 |
平成23年4月~平成28年3月 |
JSTはこの領域で、炎症が慢性化する機構を明らかにし、慢性炎症を早期に検出し、制御し、消退させ、修復する基盤技術の創出を目指しています。上記研究課題では、腸管の恒常性維持および破綻のメカニズムを解明することにより、慢性炎症性腸疾患の新規治療・予防・診断法の開発を目指しています。
また、農研機構・生物系特定産業技術研究支援センターBRAIN、厚生労働科学研究費補助金、科学研究費補助金、ヤクルトバイオサイエンス研究財団の支援により得られた研究成果の一部を含みます。
<研究の背景と経緯>
腸は、食べ物や腸内細菌といった生体にとって有益なものを含め、さまざまな抗原に常時さらされています。そのため、腸に存在する免疫細胞は、それらの有益な異物に対して過度な反応や活性化することがないように恒常性注4)が維持されています。しかし、ひとたび恒常性の維持機構が破綻すると、炎症性腸疾患などの免疫疾患が引き起こされると考えられています。
肥満細胞は、活性化によりアレルギー反応を引き起こす一方で、敗血症や皮膚炎などの炎症疾患では、炎症を抑制することや、感染症から身を守る働きを持っていることも報告されています(参考文献Ⅰ)。このように、多様な役割を担っている肥満細胞ですが、炎症性腸疾患にどのように関与しているのかはよく分かっていませんでした。1970年代に、炎症性腸疾患の患者の腸では肥満細胞の活性化を示す形態変化が見られることが、組織切片の観察から報告されました(参考文献Ⅱ)。本研究グループは、粘膜免疫学を背景とする自らのグループの理論的・技術的基盤を駆使して、マウス腸管から肥満細胞の単離精製を世界に先駆けて行い、腸管肥満細胞を標的とした腸疾患に対する新規予防・治療法の開発を目指してきました(参考文献Ⅲ)。
<研究の内容>
本研究グループは、炎症性腸疾患における肥満細胞の役割を解析する目的で肥満細胞欠損マウスを用いて炎症性腸疾患の発症を解析しました。その結果、肥満細胞欠損マウスでは、炎症性腸疾患の炎症が軽減されることが示されました(図1)。このことから、肥満細胞は、炎症性腸疾患の発症と慢性化においては、いわゆる「悪玉」として働くことが分かりました。
肥満細胞は、感染防御や敗血症や皮膚炎の抑制にも働くという「善玉」としての役割も知られていますので、炎症性腸疾患の抑制の場合には、腸管に存在する「悪玉」肥満細胞のみを標的とした新規予防・治療を目指す必要があります。倉島研究員らは、腸管粘膜から肥満細胞を精製単離する手法、さらには腸管に存在する肥満細胞だけを認識する抗体の樹立に成功しました(図2a)。樹立した抗体の中で1F11抗体は、皮膚に存在する肥満細胞は認識せずに、腸管の肥満細胞には強く反応する抗体であることが分かりました(図2b)。そこで、1F11抗体を腸炎誘導マウスに投与すると、肥満細胞の活性化が減弱し、炎症反応も低下することが示されました(図2c)。
そこで、この1F11抗体が肥満細胞のどの分子を認識しているのか探索した結果、肥満細胞の表面に発現しているP2X7たんぱく質(受容体)であることが分かりました。P2X7受容体は、腸内細菌や傷害を受けた組織から遊離、放出される細胞外のアデノシン三リン酸(ATP)を認識します。そこで、この細胞外ATPを肥満細胞に作用させると、好中球の動員を促すケモカインや炎症性サイトカイン、脂質メディエーター注5)といった物質が放出されることが示されました。そして、P2X7受容体がない肥満細胞を持ったマウスでは、炎症性腸疾患の発症が抑制されることも明らかになりました(図3)。
炎症時に細胞外に放出されるATPは、腸内細菌や傷害を受けた組織の細胞に由来すると報告されていますが、このATPは細胞外では速やかに加水分解されると考えられてきました。しかし、本研究グループの解析により、肥満細胞はATPを産生する酵素を介して細胞外ATPを増幅する新たな機構を持っていることが分かりました(図4)。また、炎症性腸疾患の1つであるクローン病の患者の腸内には、P2X7受容体を持つ肥満細胞の顕著な集積が観察されました(図5)。このことから、炎症性腸疾患においては、炎症の誘因物質である細胞外ATPの増幅と、それを認識するP2X7受容体を持つ腸の肥満細胞が、炎症の悪化を引き起こしていることが明らかとなりました。
<今後の展開>
本研究によって、腸管の肥満細胞はP2X7受容体を高発現し、細胞外ATPと結合することで炎症性腸疾患の炎症の発症と悪化に寄与していることが明らかとなりました。細胞外ATPによる肥満細胞の活性化を抑えることが、炎症性腸疾患の新たな治療標的となることが期待されます。またマウスにおいて、P2X7受容体は腸管に存在する肥満細胞に発現するのに対し、皮膚の肥満細胞では発現していないことも分かりました。さらに、炎症性腸疾患の患者の腸管の肥満細胞ではP2X7受容体の発現レベルが増加していることが証明されました。
本研究グループは、P2X7受容体の発現制御の解明が次なる課題であると考えています。P2X7受容体と肥満細胞は、臓器移植の際の拒絶反応や、関節炎、ぜんそくといったさまざまな疾患に関係すると考えられているため、P2X7受容体の発現調節機構の解明は、これらの疾患に対する新たな病態の解明や予防、治療法の確立につながることが期待されます。
<参考図>
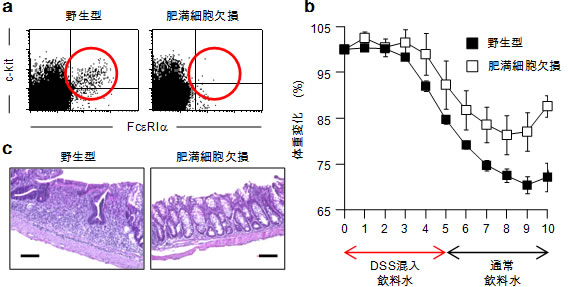
図1 肥満細胞欠損マウスでは炎症性腸疾患が軽減する
a)野生型、および肥満細胞(c-kit陽性、FcεRIα陽性)欠損マウスの腸管の肥満細胞。赤丸内部が肥満細胞。
b)マウスにデキストラン硫酸ナトリウム(DSS)の投与をし、炎症性腸疾患を誘導した際の体重の変動率。肥満細胞を欠損させたマウスでは、体重減少が抑制された。
c)誘導10日後の大腸組織像。
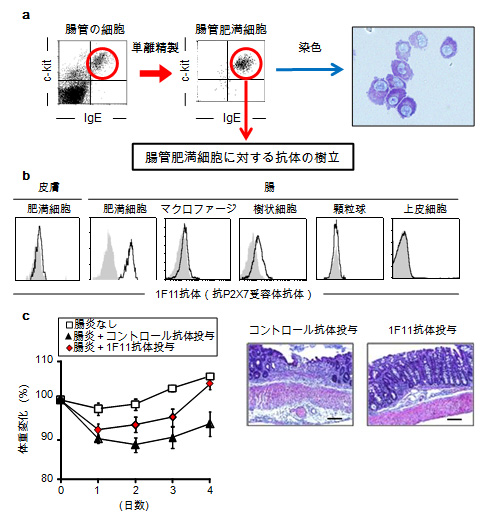
図2 腸管肥満細胞に対する抗体(1F11抗体)の作製と炎症性腸疾患に対する効果
a)腸管肥満細胞(c-kit陽性、IgE抗体陽性)を単離精製し免疫源として用いることで、抗肥満細胞抗体の樹立を行った。
b)皮膚と腸管の肥満細胞および他の腸管の細胞を1F11抗体(抗P2X7受容体抗体)で染色。灰色はアイソタイプコントロール抗体での染色を示す。1F11抗体は、腸の肥満細胞を認識するものの、皮膚の肥満細胞など他の細胞への反応性は低いことが分かった。
c)炎症性腸疾患をマウスに誘導する際に1F11抗体を投与することで、炎症の軽減が観察された。
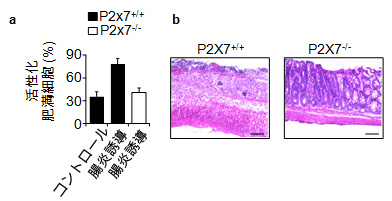
図3 P2X7受容体を持つ肥満細胞は腸炎を悪化させる
a)野生型肥満細胞(P2X7+/+)とP2X7受容体欠損肥満細胞(P2X7-/-)を、肥満細胞欠損マウスに移入した後に、腸炎の誘導を試みた。腸炎の誘導後の大腸内の肥満細胞の活性化の割合から、P2X7受容体を持たない肥満細胞は、活性化がコントロール群と同様のレベルであることが分かる。
b)腸炎誘導4日後のマウス大腸の組織像。野生型肥満細胞移入群(P2X7+/+)(左)では顕著な細胞の浸潤が観察されるのに対して、P2X7受容体欠損肥満細胞移入群(P2X7-/-)(右)では観察されない。
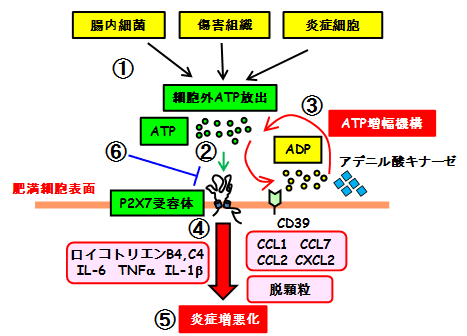
図4 P2X7受容体による腸管肥満細胞活性化
① 腸内細菌や傷害を受けた組織(細胞)、活性化した炎症細胞から細胞外にATPが放出されます。
② 細胞外ATPは、腸管肥満細胞に高いレベルで発現しているP2X7受容体に作用します。
③ 細胞外ATPは、CD39などの細胞表面に発現する加水分解酵素により分解されます。肥満細胞は、アデニル酸キナーゼの働きによって、細胞外ATPの増幅を行い、ATP-P2X7受容体依存的な活性化を促進させます。
④ 肥満細胞をATPで刺激をするとP2X7受容体を介して、IL-6、TNFα、IL-1βなどの炎症性サイトカインやロイコトリエンといった脂質メディエーター、他の炎症性細胞の動員に関与するケモカインや脱顆粒に伴うヒスタミンなどが包括的に産生されます。
⑤ これらの炎症性メディエーターによって、炎症の悪化が引き起こされると考えられます。
⑥ P2X7受容体依存的な腸管肥満細胞の活性化の抑制が炎症性腸疾患の新たな治療戦略となりえます。
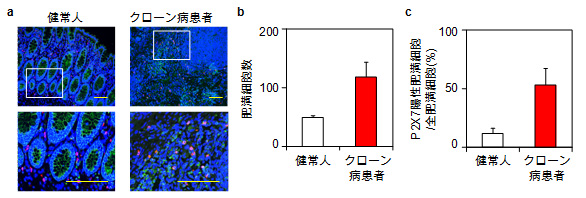
図5 炎症性腸疾患患者の腸管にはP2X7受容体を持つ肥満細胞が集積している
a)健常人とクローン病患者の大腸組織中の肥満細胞(赤)とP2X7受容体(緑)。
b)腸管肥満細胞数(顕微鏡視野内)。
c)健常人とクローン病患者の大腸組織中のP2X7受容体を持つ肥満細胞の割合。
<用語解説>
- 注1) 炎症性腸疾患
- 炎症性腸疾患は慢性の難治性疾患であり、主要な疾患としてクローン病と潰瘍性大腸炎が挙げられる。近年日本でも患者数が顕著に増加している。原因は不明であり、原因究明と根本的治療の開発が必要急務である。免疫学的なバランスの破綻が主因として考えられるが、多因子病として認識されている。
- 注2) 肥満細胞
- 自然免疫細胞の1つで、マスト細胞とも呼ばれる。粘膜組織や結合組織に散在しており、活性化に伴う脱顆粒反応によるヒスタミンの産生はアレルギー反応の原因であることが知られている。
- 注3) アデノシン三リン酸(ATP)
- ATPは、エネルギー代謝など、細胞内の重要な反応に欠かせない物質である。近年、このATPが細胞外に放出され、受容体(P2X受容体とP2Y受容体)に作用することで、情報伝達物質としても働くことが知られている。
- 注4) 恒常性
- 私たちの免疫系には、自己抗原、経口抗原、共生細菌に対して、過度な免疫反応を抑える機構(免疫寛容)が備わっている。これにより免疫応答の抑制と活性化のバランスが保たれている。
- 注5) ケモカインや炎症性サイトカイン、脂質メディエーター
- 細胞から産生される因子で、これら因子の受容体を持つ細胞に作用することで、細胞の活性化や遊走を誘導もしくは抑制する。
<参考文献>
Ⅰ.Bischoff, S.C. Role of mast cells in allergic and non-allergic immune responses: comparison of human and murine data. Nat. Rev. Immunol. 7, 93–104 (2007).
Ⅱ.Dvorak, A.M. et al., Mast-cell degranulation in Crohn's disease. Lancet. 1(8062):498 (1978).
Ⅲ.Kurashima, Y. et al. Sphingosine 1-phosphate-mediated trafficking of pathogenic Th2 and mast cells for the control of food allergy. J. Immunol. 179, 1577–1585 (2007).
<論文タイトル>
“Extracellular ATP mediates mast cell-dependent intestinal inflammation through P2X7 purinoceptors”
(細胞外ATP-P2X7受容体を介した肥満細胞の活性化による炎症性腸疾患の炎症悪化機構)
doi: 10.1038/ncomms2023
<お問い合わせ先>
<研究に関すること>
清野 宏(キヨノ ヒロシ)
東京大学 医科学研究所 炎症免疫学分野 教授
國澤 純(クニサワ ジュン)
東京大学 医科学研究所 炎症免疫学分野 准教授
〒108-8639 東京都港区白金台4-6-1
Tel:03-5449-5271 Fax:03-5449-5411
E-mail:
<JSTの事業に関すること>
石井 哲也(イシイ テツヤ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: