本研究成果のポイント
- PD-1ミクロクラスターがT細胞の過剰な活性化を直接制御
- PD-1ミクロクラスターが、シグナル伝達分子群を直接脱リン酸化
- 免疫抑制メカニズムに基づいた新たな免疫治療や創薬の可能性に期待
理化学研究所(野依 良治 理事長)は、免疫応答の核となるT細胞の活性化や増殖を抑制する補助刺激受容体注1)PD-1(Programmed Cell Death-1)注2)が、集合体(ミクロクラスター)を形成し、T細胞の過剰な活性化を抑制していることを明らかにしました。これは、理研 免疫・アレルギー科学総合研究センター(谷口 克 センター長) 免疫シグナル研究グループの斉藤 隆 グループディレクター(副センター長、大阪大学 免疫学フロンティア研究センター 招へい教授兼務)、横須賀 忠 上級研究員(科学技術振興機構 さきがけ研究員兼務)と、大阪大学 免疫学フロンティア研究センター、東京医科歯科大学 大学院医歯学総合研究科との共同研究による成果です。
免疫応答は、ウイルスや花粉などの抗原が体内へ侵入したことを察知し、生体を防御するための仕組みです。T細胞は、これらの抗原を感知して活性化し、増殖、細胞傷害活性、情報伝達物質の産生などを行い、特に長期的な免疫応答を制御しています。抗原が侵入すると、T細胞は抗原を取り込んだ抗原提示細胞注3)と接着し、その接着面に免疫シナプス注4)を形成することで、抗原の情報を受け取ります。研究グループはこれまでに、免疫シナプスの中に、T細胞受容体を核としたさまざまなシグナル伝達分子から成る集合体「ミクロクラスター」を発見、これがT細胞の抗原認識とその活性化情報を伝える“ユニット”であり、免疫応答の開始点であることを明らかにしてきました。
T細胞の活性化を抑制する分子として知られる補助刺激受容体PD-1は、慢性C型肝炎やエイズウイルス感染などの慢性炎症の抑制にも重要であることが分かり、臨床応用に向けて研究が進んでいます。2009年には、加齢に伴う免疫機能異常のマーカー分子であることも分かりました。しかし、PD-1を介するT細胞抑制メカニズムの詳細はいまだ判明していません。
今回、研究グループは、PD-1がT細胞受容体やシグナル伝達分子と共にミクロクラスターを形成し、シグナル伝達分子群を直接脱リン酸化して、T細胞の活性化を抑えていることを、分子イメージング注5)技術を使って発見しました。その結果、T細胞は免疫シナプスを保持できず動き出してしまい、T細胞活性化情報の伝達が中断されることも分かりました。
今回、PD-1による新たなT細胞の抑制メカニズムが明らかになったことで、慢性ウイルス感染やがんに対する免疫応答の強化だけでなく、移植拒絶、アトピー性皮膚炎、リウマチといった自己免疫疾患の過剰な免疫応答の緩和など、免疫治療のさらなる進歩が期待できます。本研究成果は、科学技術振興機構 戦略的創造研究推進事業 個人型研究(さきがけ)研究領域「炎症の慢性化機構の解明と制御」(研究総括:高津 聖志 富山県薬事研究所 所長)における研究課題「MAPK経路の分子イメージングによるT細胞活性化遷延機構の解明」(研究者:横須賀 忠)の一環として行われ、米国の科学雑誌『The Journal of Experimental Medicine』(5月28日付け:日本時間5月28日)にオンライン掲載されます。
<背景>
生体を外敵から守る免疫応答は、まずウイルスや花粉などの異物が抗原提示細胞によって取り込まれ、抗原としてT細胞に提示されることから始まります。その後、抗原を認識したT細胞は活性化し、さまざまな情報伝達物質を放出したり、がん細胞やウイルス感染細胞を殺したり、抗体産生を促すなど、より特異的で高度な免疫応答を長期にわたり引き起こします。抗原認識の際、T細胞は抗原提示細胞と強く接着し、その接着面には、T細胞受容体を中心に、細胞内のシグナル伝達分子が同心円状に並びます。この構造は、神経細胞のシナプスに似ていることから、「免疫シナプス」と呼ばれるようになりました(図1)。2005年に免疫シグナル研究グループは、免疫シナプスの中に、T細胞受容体と、リン酸基を付加する酵素キナーゼやタンパク同士の結合に必要なアダプターなどのシグナル伝達分子から構成される分子の集合体「ミクロクラスター」が存在し、これがユニットとして、T細胞活性化の開始と維持を行うことを明らかにしました(2005年11月7日プレスリリース:http://www.riken.jp/r-world/info/release/press/2005/051107/index.html)。
T細胞の活性化には、T細胞受容体ミクロクラスターからのシグナルの他に、補助刺激受容体からのシグナルがバランス良く伝わることが必要と考えられています。免疫シグナル研究グループはこれまで、正の補助刺激受容体であるCD28もミクロクラスターとなり、特殊なキナーゼとともに免疫シナプス中心部で新たな活性中心を作り、T細胞の活性化を増強していること(2008年10月10日プレスリリース: http://www.riken.jp/r-world/info/release/press/2008/081010/index.html)、
また、負の補助刺激受容体であるCTLA-4もミクロクラスターとなり、CD28の活性中心を破壊することでT細胞の活性化を抑制していることを明らかにしました(2010年9月24日プレスリリース: http://www.riken.jp/r-world/info/release/press/2010/100924/index.html)。
近年、もう1つの負の補助刺激受容体PD-1が、より広範にT細胞の活性化を抑制する分子として注目されています。PD-1の遺伝子を欠損したマウスが、ループス腎炎や関節炎、拡張型心筋症などの全身性自己免疫疾患により死亡することから、PD-1は長期的なT細胞の活性化抑制に重要であると考えられています。慢性C型肝炎やエイズウイルス感染などの慢性炎症の際に出現する消耗T細胞注6)もPD-1を高発現しており、PD-1のリガンド注7)への結合を阻止することで消耗T細胞の機能が回復することから、PD-1の中和抗体も臨床応用されつつあります。また、PD-1は、加齢に伴うT細胞免疫応答性の低下を示す「免疫老化」のマーカー分子であることも示されました。しかし、臨床的な有用性が先行しているのに対し、PD-1を介するT細胞抑制メカニズムの解明は進んでいません。これまでは、マウスによる個体レベルでの解析や細胞を用いた生化学的解析が中心で、分子レベルの解析は行われていませんでした。そこで研究グループは、PD-1がT細胞の活性化をどのように抑制するか、分子レベルの解析に挑みました。
<研究手法と成果>
T細胞でのPD-1分子のリアルタイムな動きを、分子イメージング技術を用いて解析するため、まず、T細胞受容体のリガンドである主要組織適合抗原複合体とPD-1のリガンドであるPD-L1をガラス平面上の人工脂質二重膜に載せた、疑似的な抗原提示細胞膜「プレイナーメンブレン」を開発しました(図2)。次に、このプレイナーメンブレン上にT細胞を置き、T細胞とプレイナーメンブレンとの接着面で起きる現象を、緑色蛍光タンパク質などを付加させた分子を指標にし、全反射蛍光顕微鏡や共焦点レーザー顕微鏡で観察しました。
観察の結果、T細胞がプレイナーメンブレンに接着すると直ちに、T細胞受容体はミクロクラスターとして集まり、集まったT細胞受容体ミクロクラスターは数分のうちに免疫シナプスの中心に移動、凝集しました。同時に、PD-1もミクロクラスターを形成し、免疫シナプスの中心に移動し、凝集しました(図3)。また、PD-1はミクロクラスターを形成する際、数十秒という短時間で、SHP2という脱リン酸化酵素注8)をミクロクラスターに呼び込み会合すること(図4)、このSHP2が、ミクロクラスターに集まるシグナル伝達分子を、直接脱リン酸化して、T細胞受容体からの活性化シグナルを抑制することが分かりました。
さらに、活性化シグナルを失ったT細胞は、免疫シナプスを保持できず、プレイナーメンブレン上を無作為に動き回り始め、その結果、T細胞の活性化が中断されることが分かりました。慢性炎症が続くと体内に現れる消耗T細胞も、PD-1を高発現しています。この消耗T細胞もPD-1のミクロクラスターを作ること、PD-1のリガンドへの結合を阻害すると、PD-1のミクロクラスターは消失し、消耗T細胞の機能が回復することも分かりました。
これまで、PD-1もCTLA-4も、T細胞の活性化を抑制する負の補助刺激受容体であることは知られていましたが、先行研究と今回の成果により初めて両者のT細胞活性化抑制メカニズムの違いを明らかにすることができました(図5)。
以上から、T細胞の活性化だけでなく、T細胞を抑制するミクロクラスターがあることが分かりました。本研究は、T細胞活性化を調節する分子のダイナミズムを観察することで、免疫応答の亢進と抑制の新たな分子メカニズムを解明したものといえます。
<今後の期待>
今回、PD-1ミクロクラスターの存在を明らかにし、その抑制のメカニズムが分かりました。CTLA-4をはじめ負の補助刺激受容体はいくつか存在しますが、それぞれが異なった調節機構を持ち、多方面からT細胞の過剰な活性化を効率良く制御していることが示唆されます。
現在、慢性C型肝炎やエイズウイルス感染を排除する、また、がん患者での免疫系を活性化するために、抗PD-1抗体や抗PD-1リガンド抗体が臨床応用され始めており、すでに臨床応用されている抗CTLA-4抗体よりも効果が顕著であると報告されています。しかし、免疫系の全身的な活性化による二次的な自己免疫疾患の発症など、阻害抗体使用による副作用も危惧されています。今回の成果は、PD-1の動態を制御するなど新しい観点からの創薬とともに、より選択的な免疫抑制剤や免疫活性剤の開発への可能性を示しており、安全で効果的な免疫治療の進歩につながると期待できます。
<原論文情報>
Tadashi Yokosuka , Masako Takamatsu , Wakana Kobayashi-Imanishi ,
Akiko Hashimoto-Tane , Miyuki Azuma , and Takashi Saito.
“Programmed cell death 1 forms negative costimulatory microclusters that directly
inhibit T cell receptor signaling by recruiting phosphatase SHP2”.
Journal of Experimental Medicine .2012.doi:10.1084/jem.20112741
doi: 10.1084/jem.20112741
<参考図>
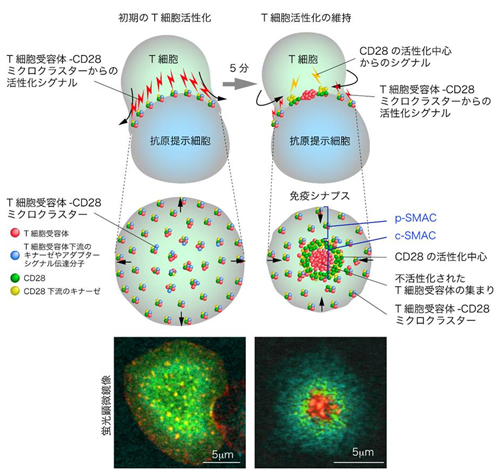
図1 免疫シナプスの構造とミクロクラスター
左上:
T細胞が抗原提示細胞に接着すると、T細胞受容体が抗原提示細胞上の抗原と結合し、T細胞受容体を核とするシグナル伝達分子の集合体「ミクロクラスター」が形成される。このミクロクラスターには、T細胞受容体下流のシグナル伝達分子が会合し、T細胞活性化シグナルを伝える活性化ドメインとしてT細胞の初期の活性化を引き起こす。正の補助刺激受容体CD28は、CD28のリガンドと結合することでミクロクラスターに集まり、CD28の下流に特異的な別のキナーゼを介してより強力なシグナルを伝える。
右上:
初期の接着から5分が経過すると、T細胞受容体は接着面の中央部に移動、T細胞受容体下流のシグナル伝達分子は解離し、活性を失う。CD28はT細胞受容体の周囲に輪状構造を構築し、CD28下流のキナーゼを留まらせることにより、T細胞受容体シグナルとは別の活性化シグナルを伝える。また、接着面の周縁部では新たなミクロクラスターが繰り返し形成され、T細胞受容体からのシグナルを伝え続ける。T細胞受容体とCD28からなる接着面の中心をCentral-supramolecular activating cluster (c-SMAC)、接着分子からなる周辺部をPeripheral-SMAC (p-SMAC)といい、この同心円状構造を免疫シナプスと呼ぶ。
下:
プレイナーメンブレンにのせたT細胞の蛍光顕微鏡像を示す。T細胞受容体(赤)、接着分子(水色)、CD28下流で働くキナーゼ(緑)。
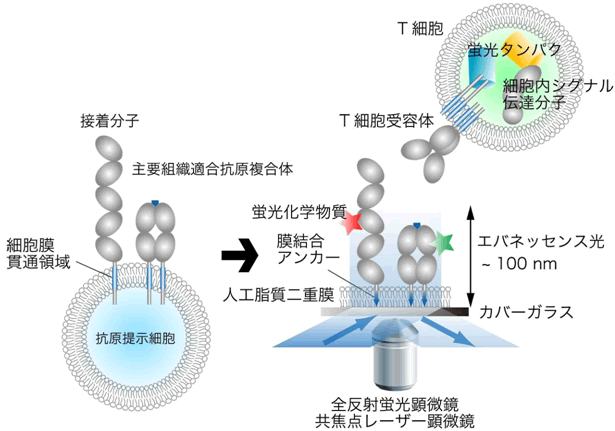
図2 プレイナーメンブレン法によるT細胞受容体および細胞内分子の観察方法
実際の細胞は丸く、また細胞膜には複雑な凸凹がある。プレイナーメンブレン法では、抗原提示細胞に発現している主要組織適合抗原複合体や接着分子などの細胞表面分子に膜結合アンカー配列を付加し、カバーガラス上に作製した平らな人工脂質二重膜に導入する。この抗原提示細胞の細胞膜を疑似したプレイナーメンブレン上にT細胞を落下させ、蛍光顕微鏡で細胞内外の分子の挙動を観察する。観察したい分子は、蛍光で標識された抗体で染色したり、直接蛍光物質を付加したりする。全反射蛍光顕微鏡はレーザーの入射角を大きくして微妙に漏れ混むエバネッセンス光を利用するため、カバーガラスから100nmといった細胞膜近傍の分子の観察が可能であり、また、このような弱い光を用いてバックグラウンドを下げることで、1分子レベルでの解析を可能にしている。また、共焦点レーザー顕微鏡では、細胞表面から細胞内部までの分子の挙動を、幅広い波長の蛍光を用いて観察することができる。
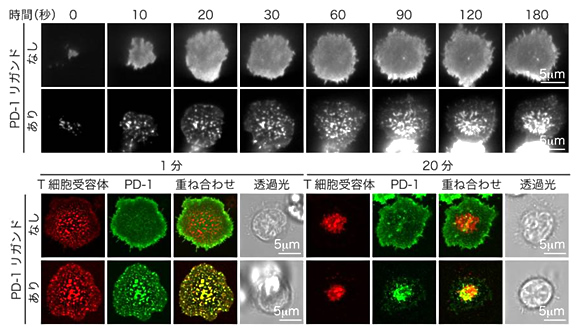
図3 T細胞受容体とPD-1ミクロクラスターの蛍光顕微鏡観察
上:
蛍光タンパク質を付加したPD-1をT細胞に遺伝子導入後、プレイナーメンブレン上に落下させ、全反射蛍光顕微鏡を用いてリアルタイム観察を行った。PD-1はリガンドがあるとクラスターを形成し、数分以内に中央部(c-SMAC)に集まった。
下:
共焦点レーザー顕微鏡を用いた、T細胞のT細胞受容体(赤)とPD-1(緑)のリアルタイム観察結果。T細胞とプレイナーメンブレンとの接着1分後、T細胞受容体とPD-1のミクロクラスターは同じ場所に形成される(黄)。20分後、T細胞受容体もPD-1も接着面の中央に集まり、c-SMACを形成する。
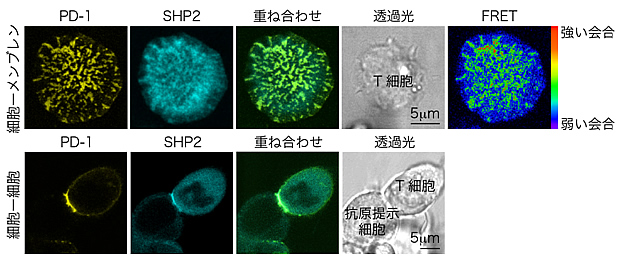
図4 PD-1ミクロクラスターに集まるSHP2
上:
蛍光タンパク質を付加したPD-1(黄)とSHP2(水色)をT細胞に導入後、プレイナーメンブレン上に落下させ、共焦点レーザー顕微鏡を用いてリアルタイム観察を行った。PD-1とSHP2のミクロクラスターが同じ部位に存在するのが観察され、蛍光共鳴エネルギー移動(FRET:Fluorescence :resonance :energy :transfer)※においても、SHP2とPD-1の会合が示された。
下:
同T細胞を抗原提示細胞と接着させ、2つの細胞の間に集まるPD-1(黄)とSHP2(水色)を、共焦点レーザー顕微鏡を用いて観察した。
※蛍光共鳴エネルギー移動(FRET:Fluorescence resonance energy transfer)
近接した2個の色素分子の間で、励起エネルギーが電子の共鳴により直接移動する現象。一方の分子(供与体)に吸収された光のエネルギーによって、他方の分子(受容体)にエネルギーが移動し、受容体から蛍光が放射される。2つの分子の数nm以内の接近を意味する。
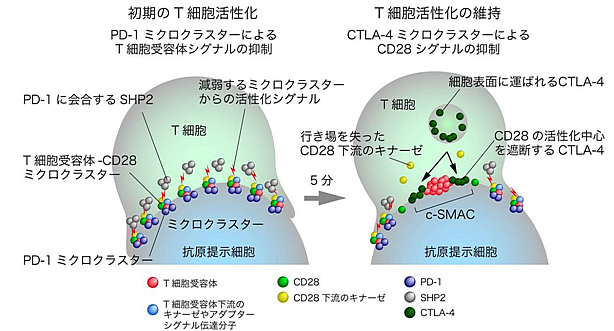
図5 PD-1とCTLA-4ミクロクラスターによるT細胞活性化抑制
左:
正常な初期のT細胞活性化は、T細胞と抗原提示細胞との接着面に形成されるT細胞受容体-CD28のミクロクラスターにより引き起こされ、主にキナーゼやアダプターなどのシグナル伝達分子が働いている。PD-1はリガンドと結合することでT細胞受容体とミクロラスターを形成し、そこに集まるキナーゼによりPD-1自身がリン酸化を受け、SHP2をミクロクラスターに呼び寄せる。次にSHP2は、T細胞受容体-CD28ミクロクラスターに集まるシグナル伝達分子を脱リン酸化し、ミクロクラスターからの活性化シグナルを減弱、つまり最初の活性化反応に対する負の制御を行う。
右:
T細胞の活性化の維持は、主にc-SMACに形成されるCD28とその下流のキナーゼからなる活性化中心によって行われる。CTLA-4はCD28からリガンドを奪い取ることで、CD28の活性中心を破壊し、CD28シグナルによるT細胞活性化を抑制する。
PD-1、CTLA-4の2つの負の補助刺激受容体は、時間的、空間的に別の方法で、異なる活性化シグナルを抑え、二重にT細胞の活性化を制御する。
<用語説明>
- 注1) 補助刺激受容体
- T細胞は、T細胞受容体からの刺激で活性化するが、それ単独の刺激だけでは、T細胞は細胞死や不応答を起こす。T細胞には、T細胞受容体以外にさまざまな補助刺激受容体が発現しており、T細胞受容体からのシグナルと協力し、T細胞の活性化、分化、増殖を調節している。補助刺激受容体には、T細胞の活性化に対し正の働きをするものと、負の働きをするものとが知られている。
- 注2) PD-1(Programmed Cell Death-1)
- PD-1は、細胞死誘導時に発現が増強されるタンパク質として、1992年に京都大学 本庶 佑研究室にて単離同定された。I型膜タンパク、免疫グロブリンスーパーファミリー分子の1つ。活性化したT細胞、B細胞、マクロファージに発現しており、リガンドにはPD-1 ligand 1(PD-L1)とPD-L2との2つが知られている。
- 注3) 抗原提示細胞
- 免疫細胞のうち、外から侵入した病原体や体内で生じた死細胞などを貪食し、抗原として自らの細胞表面上に提示する能力を持つ細胞を示す。代表にマクロファージや樹状細胞などがある。抗原提示細胞は、外来抗原によって自らも活性化する(自然免疫)とともに、T細胞やB細胞を活性化し、より特異的で高度な免疫応答(獲得免疫)を誘導する。
- 注4) 免疫シナプス
- T細胞と抗原提示細胞とが接着した際、その接着面に構築される、細胞表面の受容体と接着分子、細胞内シグナル伝達分子からなる同心円状の構造を示す。直径約10μmで、中心部をCentral-supramolecular activating cluster (c-SMAC)、接着分子からなる周辺部をPeripheral-SMAC (p-SMAC)と呼ぶ。神経細胞のシナプスに似ていることから「免疫シナプス」と名付けられた。B細胞やナチュラルキラー細胞など、細胞間相互作用を行う免疫細胞の接着面に広く見られる(図1参照)。
- 注5) 分子イメージング
- 細胞内や生体内の分子を可視化する技術。蛍光を用いて、蛍光顕微鏡やレーザー顕微鏡で観察する場合が多い。着目している分子と蛍光タンパク質との融合タンパク質を細胞内で発現させたり、蛍光物質で標識した抗体を用いたりするため、細胞内外の分子の動きを、細胞が生きたまま観察することもできる。蛍光タンパク質や蛍光物質には、発光波長の違いによりさまざまな色がある。緑色蛍光タンパク質であるGFP(Green Fluorescence Protein)が基本になっているが、複数の色を組み合わせることにより、多数の分子を同時に観察することができる。
- 注6) 消耗T細胞
- 長期的な感染や担がん状態のように抗原刺激が慢性的に及んだ場合、本来反応すべき外来抗原に対して無反応になったT細胞を示す。消耗T細胞はPD-1を高発現しており、PD-1のリガンドへの結合を阻害すると、T細胞の反応性が回復することが知られている。
- 注7) リガンド
- 受容体(レセプター)が結合する相手方の分子のこと。受容体はリガンドと結合することで、受容体から、細胞質や核にある次の分子へと情報が伝達される。
- 注8) 脱リン酸化酵素
- リン酸化されたチロシン残基、スレオニン残基、セリン残基などからリン酸基を外す酵素。リン酸基を取り除くことは、シグナルの遮断を意味する。
<お問い合わせ先>
<研究に関すること>
理化学研究所 免疫・アレルギー科学総合研究センター 免疫シグナル研究グループ
グループディレクター
斉藤 隆(さいとう たかし)
Tel:045-503-7037 Fax:045-503-7036
科学技術振興機構 さきがけ上級研究員
横須賀 忠(よこすか ただし)
Tel:045-503-7039 Fax:045-503-7036
横浜研究推進部 企画課
Tel:045-503-9117 Fax:045-503-9113
<報道に関すること>
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432