ポイント
- 脳梗塞では梗塞部位の炎症反応が症状を悪化させるが、その仕組みに謎が残っている
- 細胞保護酵素ペルオキシレドキシンの細胞外放出が炎症の引き金であると判明
- 細胞外ペルオキシレドキシン阻害で、マウスの症状改善-新たな治療標的として期待
JST 課題達成型基礎研究の一環として、慶應義塾大学の七田 崇(シチタ タカシ) 助教、吉村 昭彦 教授らは、脳梗塞後の炎症反応を引き起こす脳内因子を新たに発見し、この脳内因子の活性を抑えると梗塞領域が縮小し、神経症状が改善することを世界で初めて確かめました。
脳梗塞は罹患率(約96万人)、および死亡率が高い(年間死亡者数:約7万人)非常に重大な疾患ですが、治療法は発症直後の血栓溶解療法など依然として限られています。従って、治療開始可能時間の広い治療法が必要とされています。近年、脳虚血後の炎症反応が神経症状を悪化させたり、脳梗塞領域を拡大させたりすることが注目されています。しかしその炎症のメカニズムはまだ十分に明らかになっておらず、また治療への応用も進んでいません。
本研究グループは、脳梗塞後のマウスの組織中にペルオキシレドキシン(peroxiredoxin:Prx)注1)
が多量に産生されて、細胞外へ放出されていることを発見し、Prxが脳内に浸潤した炎症細胞を活性化することにより炎症を引き起こして、脳梗塞領域の拡大、神経症状の悪化につながることを証明しました。さらに、脳虚血を起こしたマウスにPrxの作用を中和する抗体を投与すると、梗塞領域が縮小し、神経症状が改善されることも明らかにしました。Prxは、これまで細胞を保護するたんぱく質と考えられていましたが、今回の研究により脳細胞が細胞死に至ると、脳梗塞を悪化させるたんぱく質になることが分かりました。
本研究によって、脳梗塞における新たな炎症メカニズムが判明しました。Prxの細胞外への放出は、人の脳梗塞患者の脳内においても報告されていることから、Prxを標的とした治療法開発につながる可能性があり、脳卒中医療に役立つことが期待されます。
本研究成果は、2012年5月20日(英国時間)の英国科学雑誌『Nature Medicine 』オンライン版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題名 |
「脳組織傷害後の慢性炎症における免疫制御機構の解明」 |
| 研究者 |
七田 崇(慶應義塾大学 医学部 微生物学・免疫学教室 助教) |
| 研究実施場所 |
同上 |
| 研究期間 |
平成23年10月~平成29年3月 |
JSTはこの研究領域で、炎症の慢性化機構という現象の実体解明に向けた研究を行い、それに基づき、がん・動脈硬化性疾患・アレルギー・自己免疫疾患などの炎症の慢性化が関与するさまざまな疾患の予防や治療、創薬につながる新たな医療基盤の創出を目指しています。本研究課題では脳神経組織における炎症の慢性化と終息に重要な役割を担う脳内因子や炎症細胞の機能を網羅的に解析することによって、炎症の終息と組織の修復に至るためのメカニズムを解明して、新規治療法の開発を目指します。
<研究の背景と経緯>
脳梗塞とは、脳の血管が詰まるなどして脳血流が乏しくなること(虚血)によって脳組織が壊死に陥る病態です。日本では患者総数96万人といわれ、がんに匹敵する患者数です(「平成20年患者調査」厚生労働省)。脳梗塞の死亡者数は年間約7万人(「平成22年人口動態統計」厚生労働省)で、死亡率が高いだけでなく、助かっても寝たきりになるなど患者の生活の質(QOL)が非常に悪いことが特徴です。これまでの脳梗塞の治療は発症直後(4.5時間以内)に血栓溶解薬を投与するなど、限られた治療法しかありませんでした。しかし梗塞後徐々に炎症が起こって脳組織が浮腫を起こして腫れることにより、梗塞領域が広がったり、病状が悪化したりすることがあり、これらを抑制することも重要と考えられています(参考文献1-3)。脳組織に炎症が起こると、壊死した組織の中に血液由来の免疫細胞(マクロファージやリンパ球)が多数存在し、活性化した免疫細胞が炎症性因子を産生することによってさらに炎症が促進されます。その結果、壊死した組織周囲の正常組織を傷つけて梗塞領域を拡大させます。特に、マクロファージは発症早期に浸潤し炎症をスタートさせる重要な細胞です。しかし、マクロファージがどのような機構で活性化されるのかは全く不明でした。
これまで、マクロファージが細菌を認識するのに使っているToll様受容体(Toll-like receptor:TLR)注2)(この分子の発見者は2011年のノーベル賞を受賞)が脳梗塞後の炎症に必要だということは分かっていました。しかし脳は無菌的でクリーンな臓器であり、細菌やウイルスなどの外敵は通常存在しません。従って、TLRに認識される何らかの物質が脳組織の中にもともと存在しており、その物質は脳組織が壊死に陥った時に細胞外にばらまかれて、TLRを介してマクロファージを刺激して活性化させると考えられます。このような物質は、ダメージ関連分子パターン( Damage-associated molecular patterns:DAMPs)注3)と呼ばれています。これまで脳内のDAMPsは不明で、治療の標的になりうるかどうかも分かっていませんでした。
<研究の内容>
今回、本研究グループは、脳組織中に存在する新規のDAMPsとしてペルオキシレドキシン(peroxiredoxin:Prx)を同定し、このPrxが壊死した脳組織の中で放出されて、浸潤したマクロファージを活性化させ、炎症を引き起こしていることを発見しました。
まず、脳組織の抽出液を作製し、これを培養したマクロファージと同様な機能を持つ樹状細胞に添加したところ、さまざまな炎症性サイトカイン(IL-23、IL-1β、TNF-αなど)を産生することが分かりました。脳抽出液を、たんぱく質分解酵素で処理すると活性能力がなくなることから、脳抽出液中の樹状細胞を活性化する物質はたんぱく質であることが分かりました。そこで、脳抽出液をさまざまに分画し最終的に質量分析計を用いた解析によって、Prxファミリーたんぱく質が樹状細胞を活性化していることを突き止めました(図2)。
Prxファミリーたんぱく質は、細菌から哺乳類まで幅広く存在し、通常は細胞内にあって過酸化水素を水に変換する酸化防止酵素として知られていました。従って、虚血などのストレスの際には大量に合成されて、細胞内の過酸化水素を水に変換して細胞を保護する働きがあると考えられていました。しかし、細胞が壊死するとPrxは細胞の外に放出されます。虚血に陥った脳組織では、壊死した組織の周りにPrxを含む細胞の残骸が集積しており、さらにマクロファージと接触していることを発見しました(図3)。これらのことは、虚血ストレスの際に細胞を生存させるために細胞内でPrxが発現されますが、細胞死に至るとPrxは細胞外に放出され、周囲に浸潤したマクロファージを活性化するメカニズムがあると考えられました(図4)。
実際に、Prxが樹状細胞を活性化するメカニズムを調べてみると、Prxは樹状細胞の表面に存在するTLR2やTLR4を介してマクロファージを活性化していることが分かりました。Prxの変異体を作製して、樹状細胞を活性化するのに必要な構造を調べたところ、Prxファミリーたんぱく質に共通して存在するα3-helixという構造がTLR2やTLR4を介してマクロファージを活性化させていることが判明しました(図5)。
次に、細胞外に放出されたPrxの活性を除去するために中和抗体を作製しました。この抗体は、試験管内で脳抽出液の樹状細胞活性化能を半分以上抑制できることが分かりました。Prx抗体を一過性脳虚血モデル注4)マウスに投与したところ、脳組織での炎症性サイトカインが抑えられ、梗塞体積が縮小し、神経症状が著しく改善しました(図6)。
いろいろな炎症でHMGB1(High mobily group box1)というたんぱく質がDAMPsとして働くことが報告されています。脳梗塞モデルにおいてもHMGB1の細胞外放出が認められましたが、HMGB1はマクロファージが脳組織に浸潤する頃には消失し、炎症を引き起こす原因には直接は関与していないことも分かりました。本研究グループの実験から、PrxはHMGB1より遅れて虚血後12時間をピークに細胞外に放出されることにより、脳組織に浸潤したマクロファージを活性化することが分かりました(図7)。
<今後の展開>
本研究によって脳梗塞における新たな炎症メカニズムが判明しました。さらに、脳梗塞患者の脳内においても同様に、Prxが細胞外に放出されていることが報告されています(参考文献4)。そのためPrxは、脳梗塞における治療開始可能時間の比較的長い治療のターゲットになり得ると考えられ、本研究の知見が脳卒中医療に応用されることが期待されます。
<付記>
本研究成果において、IL-23の誘導因子が存在することを確かめるにあたり、JST 戦略的創造研究推進事業 チーム型研究(CREST)「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」研究領域(研究総括:菅村 和夫 宮城県立病院機構 理事長)における研究課題「細胞内シグナル制御による免疫リプログラミング」(研究者:吉村 昭彦 慶應義塾大学 医学部 微生物学・免疫学教室 教授)の支援を受けました。
<参考図>
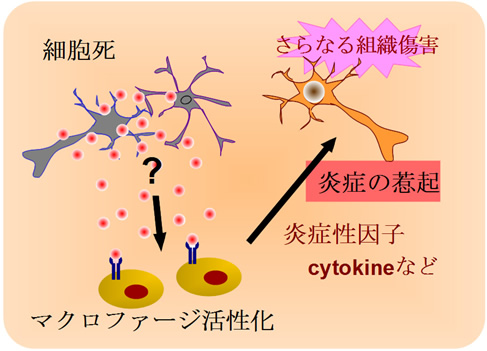
図1 脳虚血による炎症を引き起こすメカニズム(仮説)
脳虚血によって組織の細胞死が起こると、何らかのメカニズムによって、脳内に浸潤した血液細胞(マクロファージなど)が活性化され、炎症性因子を産生することによりさらなる組織傷害が引き起こされる。
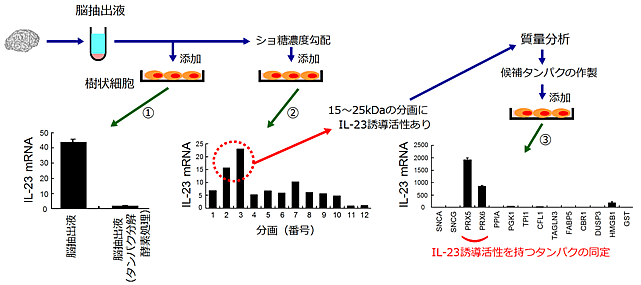
図2 脳抽出液中に存在する、IL-23誘導活性を持つたんぱく質の同定
-
①脳をすり潰した抽出液を樹状細胞に添加すると炎症性サイトカインの一種であるIL-23が産生される。たんぱく質分解酵素で処理した脳抽出液ではIL-23は誘導されない。
-
②脳抽出液をショ糖濃度勾配によって分子量で分画すると、15~25kDaの分画にIL-23誘導活性があることが分かった。IL-23誘導活性のある分画を質量分析計で解析し、候補となるたんぱく質を同定した。
-
③リコンビナントたんぱく質を作製し、樹状細胞に添加したところPrxファミリーたんぱく質に強いIL-23誘導活性を認めた。
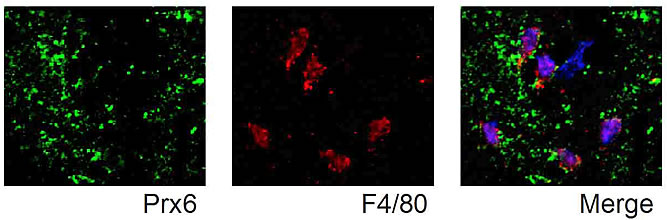
図3 Prxは細胞外に放出されてマクロファージを刺激する
- 発症1日目の梗塞中心における免疫染色像を示す。
- 左:Prx6を高発現する多量のdebris(壊死した組織の残骸)が存在する(緑色)。
- 中:F4/80陽性細胞(マクロファージ)が脳内に浸潤している(赤色)。
- 右:Prx6を含むdebrisがマクロファージの細胞表面上に共局在している。
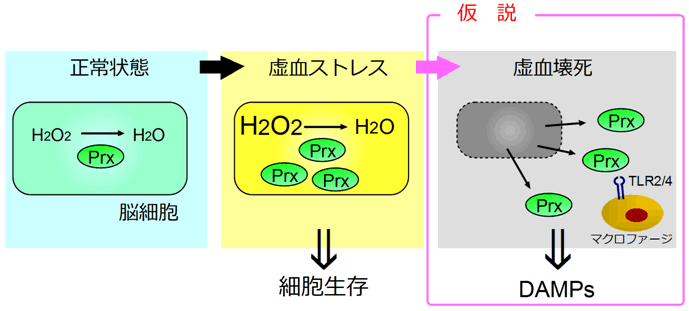
図4 Prxは細胞内外で異なる働きを持つ
Prxは過酸化水素(H2O2)を水(H2O)に代謝する。虚血ストレスによって細胞内の過酸化水素が増えると、Prxが細胞内で発現されて過酸化水素を代謝することにより、細胞を生存させる。しかし細胞が壊死すると、細胞内のPrxはdebrisとともに細胞外に放出されて、脳内に浸潤したマクロファージにTLR2とTLR4を介して作用する(DAMPsとなる)。
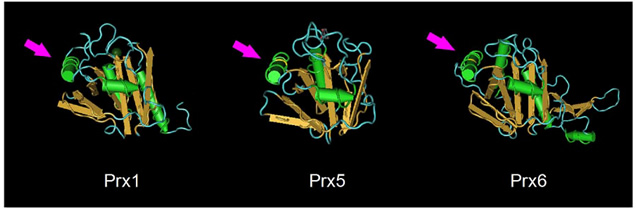
図5 Prxは共通して、炎症を誘導するための活性部位を持つ
Prxは、TLR2やTLR4を介して樹状細胞に炎症性サイトカインを産生させるための共通構造(矢印:α3-helixを示す)を持つ。
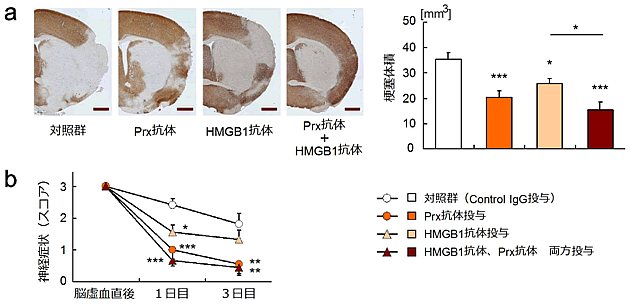
図6 一過性脳虚血モデルマウスにおけるPrx抗体、HMGB1抗体投与の効果
脳虚血誘導直後に抗Prx抗体、抗HMGB1抗体、またはその両方を投与して、
(a)発症4日目の梗塞体積(染色像はMAP2染色:白い部分が梗塞巣を示す)、
(b)発症直後から3日目までの神経症状の推移を示す。
*: P<0.05、* * *: P<0.001 vs 対照群
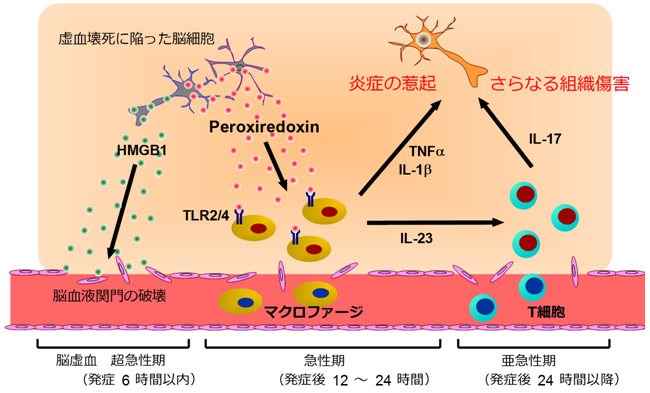
図7 脳虚血における炎症を引き起こす因子としてのPrxの役割
脳虚血における炎症の経時変化を示す。発症6時間以内の超急性期には、虚血に陥った脳細胞からHMGB1が放出され、これは脳血液関門の破壊に寄与する。発症12~24時間以内の急性期にはマクロファージの浸潤が著明になるが、HMGB1の放出は見られなくなる。代わりに、虚血ストレスによって細胞内で発現したPrxが細胞死に伴って細胞外に放出され、浸潤したマクロファージをTLR2やTLR4依存的に活性化し、IL-23やIL-1β、TNFαを産生させる。IL-23はさらに遅れて脳内に浸潤したT細胞(γδT細胞)からIL-17を産生させ、さらなる組織傷害を引き起こす。
<用語説明>
- 注1) ペルオキシレドキシン(peroxiredoxin:Prx)
- ペルオキシレドキシンは、細胞毒である過酸化水素(H2O2)などの活性酸素種を無毒化する抗酸化酵素として、細菌や高等植物の細胞内にも存在することが知られていていた。哺乳動物ではこれまでに、6種類(Prx1~Prx6)のPrxファミリーたんぱく質が同定されている。
- 注2) Toll様受容体(Toll-like receptor:TLR)
- 自然免疫の機能を持つ受容体。主に細菌のリポ多糖やリポたんぱく質、ウイルス由来のDNAやRNAを認識して細胞内シグナルを伝えることにより、さまざまな免疫応答を引き起こす。組織傷害によって放出されたDAMPsを認識する受容体としても注目されている。
- 注3) ダメージ関連分子パターン(Damage-associated molecular patterns:DAMPs)
- 組織傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のこと。HMGB1やHSP(Heat shock protein)、ヒアルロン酸、酸化型LDLなどがDAMPsとして機能することが知られている。
- 注4) 一過性脳虚血モデル
- 脳梗塞の動物モデルとして知られている。脳血管を閉塞する方法はさまざまだが、本研究では、細い塞栓糸を頚動脈から挿入して脳血管(中大脳動脈)に到達させ、閉塞させる手技を用いている。挿入した塞栓糸を引き抜くことにより、脳血管の閉塞を解除させることができる。そのため一過性虚血再還流モデルとも呼ばれる。
<論文名>
“Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain.”
(脳虚血後の炎症惹起因子としてのperoxiredoxinの役割)
doi: 10.1038/nm.2749
<参考文献>
参考文献1:
Iadecola C, Anrather J. The immunology of stroke: from mechanisms to translation. Nat Med. 17, 796-808 (2011)
参考文献2:
Shichita T, et al. Pivotal role of cerebral interleukin-17-producing gammadeltaT cells in the delayed phase of ischemic brain injury. Nat Med. 15, 946-950 (2009)
参考文献3:
Moskowitz MA, Lo EH, Iadecola C. The science of stroke: mechanisms in search of treatments. Neuron. 67, 181-198 (2010)
参考文献4:
Dayon L, et al. Brain extracellular fluid protein changes in acute stroke patients. J Proteome Res. 10, 1043-1051 (2011)
<お問い合わせ先>
<研究に関すること>
七田 崇(シチタ タカシ)
慶應義塾大学 医学部 微生物学・免疫学教室 助教
吉村 昭彦(ヨシムラ アキヒコ)
慶應義塾大学 医学部 微生物学・免疫学教室 教授
〒160-8582 東京都新宿区信濃町35 東校舎4F
Tel:03-5363-3483 Fax:03-5360-1508
E-mail: (七田)、
(七田)、 (吉村)
(吉村)
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)、木村 文治(キムラ フミハル)、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2063
E-mail: