ポイント
- ウイルスやバクテリア感染時の新しい自然免疫応答制御機構が明らかに
- 重複感染症の新規治療法に道
- アレルギー・自己免疫疾患の発症および抑制の仕組み解明にも新たな可能性
JST 課題達成型基礎研究の一環として、東京大学 生産技術研究所・分子免疫学分野の根岸 英雄 特任助教、柳井 秀元 特任助教らの研究グループは、ウイルスとバクテリアの重複感染によって重篤な症状が引き起こされる分子機構の1つを解明しました。ウイルスに感染した患者が、さらなるバクテリアの感染によって、非常に重篤な症状を起こすことが広く知られていますが、その背後にある分子機構についてはよく分かっていませんでした。
本研究グループは、ウイルスに対して活性化する生体の防御応答が、同時にバクテリアに対する防御応答を抑制する性質を持っていることを発見しました。さらにその分子制御機構について詳細に調べたところ、ウイルス由来の核酸により強力に活性化されるIRF3という転写因子が、ウイルスを攻撃するために必須であるインターフェロン(IFN)の遺伝子を活性化する一方、バクテリアを攻撃するために重要なIL-12p40の遺伝子を抑制するという二面性があることが新たに判明しました。この機構により、ウイルスに感染したマウスではバクテリア感染に対する免疫応答が強く抑制されることが明らかとなりました。IRF3による抗バクテリア応答抑制機構は免疫応答の弱点ともいえ、さまざまなウイルス/バクテリアによる重複感染症に関与していると考えられます。一方で、IL-12p40はT細胞応答を制御する重要な遺伝子であり、T細胞応答が引き起こすさまざまなアレルギー・自己免疫疾患に関与すると考えられています。そのため、今後、この仕組みをさらに詳細に解析することによって、アレルギー・自己免疫疾患抑制機構の理解やさまざまな重複感染症の治療法の確立につながる可能性があります。
なお本研究は、本研究グループが東京大学 大学院医学系研究科 免疫学教室在籍中に行われたもので、東京大学 大学院医学系研究科 免疫学教室の本田 賢也 准教授、中島 啓 研究員らと共同で行ったものです。
本研究成果は、2012年5月20日18時(英国時間)に英国科学誌「Nature Immunology」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立病院機構 理事長)
|
| 研究課題名 |
「核酸を主体とした免疫応答制御機構の解明とその制御法の開発」 |
| 研究代表者 |
谷口 維紹 |
| 研究期間 |
平成21年11月~平成27年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、核酸に対する自然免疫応答の仕組みの解析やそれを制御する物質の単離を行なうことで、感染防御や自己免疫疾患における免疫応答の制御法の確立を目指します。
<研究の背景と経緯>
ウイルスとバクテリアの重複感染がそれぞれの病原体の単独の感染と比較して重篤な症状を引き起こすことは広く知られ、重複感染症として臨床的にも重要な疾患ですが、なぜそのような重複感染が症状を重篤化するかについてはよく分かっていませんでした。このような重複感染症は、呼吸器系のウイルス感染時に起こるケースが良く知られていることから、インフルエンザなどいくつかのウイルス種については、そのウイルスが持つ特性として、抗バクテリア応答を抑える機構が存在するという報告もありました。しかし、当然このような機構は特定のウイルス種に限られたものであり、それ以外のさまざまなウイルス/バクテリアの組み合わせで引き起こされる、多様な重複感染症の背後にあるメカニズムを説明できるものではありませんでした。また、今までの重複感染症の解析の焦点は主に病原体の性質であり、宿主の免疫応答、特に自然免疫応答のシグナル経路に主眼をおいた解析はほとんどありませんでした。
感染に対する生体防御の仕組みはさまざまな病原体認識受容体のシグナル経路が調べられており、ウイルス感染に対抗する受容体経路の1つとしてRLR注1)経路(RIG-I様受容体経路)を介して、IRF3という転写因子が活性化され、主にⅠ型IFNを誘導してウイルス感染からの生体防御に関与していることが分かっていました。またバクテリア感染時はTLR注2)経路(Toll様受容体経路)がバクテリア感染からの生体防御に重要な役割を果たしていることも分かっていました。しかし、RLR経路とTLR経路において引き起こされる免疫応答の違いやその詳細な仕組み、さらに、重複感染の際に互いの経路がどう影響しあっているかは分かっていませんでした。
<研究の内容>
本研究グループは生体のウイルスとバクテリアに対する免疫応答に焦点をあてて、発現される遺伝子、誘導される免疫応答を比較解析することで、ウイルス、バクテリアに対する特異的な応答を詳細に解析しました。まず、自然免疫応答を担う抗原提示細胞における感染時の遺伝子誘導を調べたところ、ウイルス感染時とバクテリア感染時で引き起こされる遺伝子誘導に大きな違いがあり、ウイルス感染時には抗ウイルス応答に必須のⅠ型IFN遺伝子が、バクテリア感染時には抗バクテリア応答に重要なIL-12p40遺伝子が強力に発現誘導されることを発見しました。また、遺伝子誘導の違いによって、抗ウイルス応答と抗バクテリア応答は全く異なった種類の適応免疫応答を誘導することを発見し、その分子制御機構を解明しました。さらに、ウイルスによって活性化される免疫応答と、バクテリアによって活性化される免疫応答の関係を解析しました。その結果、抗原提示細胞においてウイルス感染によって活性化したシグナルが、IL-12p40遺伝子の発現を抑制することを発見し、この現象と重複感染症との関係について検証を行ないました。
① 本研究グループは、まず初めにウイルス感染とバクテリア感染によって抗原提示細胞で誘導される遺伝子群を網羅的に比較解析しました。その結果、ウイルス感染ではRLR経路(RIG-I様受容体経路)を介してⅠ型IFN遺伝子群が、バクテリア感染ではTLR経路(Toll様受容体経路)を介してIL-12p40遺伝子の発現が強力かつ特異的に発現誘導されることが分かりました(図1)。これらの遺伝子は、それぞれ抗ウイルス応答および抗バクテリア応答に必須の遺伝子であり、特にIL-12p40は適応応答の方向をコントロールし、Th1/17細胞注3)応答を活性化します。そのため、ウイルス感染またはバクテリア感染で誘導される適応免疫応答を比較すると著明な差異があり、前者はより強くTh2細胞注4)応答を誘導する一方で、後者はTh1/17細胞応答を顕著に誘導することも分かりました。
② ウイルス/バクテリアそれぞれの感染で特異的に誘導される免疫応答が明らかとなったため、次に本研究グループは、ウイルス感染によって活性化する応答が、バクテリア感染によって活性化される応答に与える影響を解析しました。その結果、ウイルス感染によってRLR経路が活性化した状態では、バクテリアによって活性化するTLR経路からのIL-12p40遺伝子の発現が強く抑制されることを発見しました(図2)。さらに、この抑制機構を解析した結果、ウイルス由来の核酸で強力に活性化されるIRF3転写因子が、IL-12p40遺伝子の発現を抑制することを発見しました。IRF3を欠損した細胞では、野生型と比較してIL-12p40遺伝子の誘導が著明に増強しました(図2)。
③ 上記の結果から、ウイルス感染がIL-12p40遺伝子の発現を抑制して、抗バクテリア応答を抑えることが考えられたので、この仮説を生体レベルで検証するため、マウスにウイルスの一種であるVSV注5)およびバクテリアの一種であるリステリア注6)を重複感染させ、抗バクテリア応答を解析しました。その結果、VSVを感染したマウスでは、IL-12p40遺伝子の発現が低下し、Th1/17細胞応答が抑制されることが分かりました。この抗バクテリア応答の抑制によって、VSV/リステリア重複感染マウスでは、リステリア単感染マウスと比較して1000倍以上にリステリアが増殖し、著明な臓器の障害および早期の死亡が起こりました。一方で、IRF3を欠損したマウスでは、重複感染時もIL-12p40の誘導が抑制されず、Th1/17細胞応答も正常に誘導されるため、野生型マウスよりも、著明な耐性を示し、生存率の著明な上昇および臓器障害の低減が認められました(図3)。
<今後の展開>
本研究で発見した抗ウイルス応答による抗バクテリア応答の抑制機構は、宿主の免疫応答の性質がもたらす免疫応答の弱点ともいえる機構であり、少なくとも検討した範囲では、ウイルス/バクテリア側の性質に依存していません。そのため、さまざまなウイルス/バクテリアによる重複感染症において、この機構が同じように関与している可能性があります。今後、この機構を標的とすることで、さまざまな重複感染症の治療法確立が期待できると考えています。
一方、IL-12p40が活性化するTh1/17細胞応答は自己免疫疾患を増悪することが知られています。ウイルス感染が自己免疫疾患の病態に関与するケースも報告されていますので、本研究において見いだされたIRF3によるIL-12p40の抑制機構は、ウイルス感染による自己免疫疾患の発症リスクを抑えるブレーキ役を果たしている可能性があります。さらに、IL-12p40にはアレルギー疾患の増悪に関与することが報告されているTh2細胞応答を抑制する性質もあることから、今回見いだされた機構がアレルギー疾患の増悪に関与していることも考えられます。今回の発見を礎として、アレルギーや自己免疫疾患の病態抑制についての理解が深まると期待されます。
<参考図>
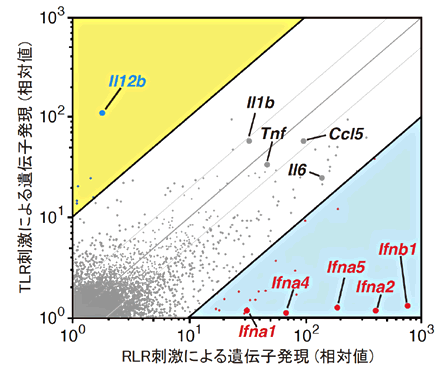
図1 TLR刺激とRLR刺激で誘導される遺伝子の網羅解析
腹腔マクロファージをRLR(B-DNA注7))刺激またはTLR(CpG-B注8))刺激し、4時間後のmRNA誘導をマイクロアレイ解析によって、網羅的に比較解析した。
ウイルスによる刺激に対してはⅠ型IFN遺伝子群が、バクテリアによる刺激に対してはIL-12p40遺伝子の発現が顕著に誘導された。
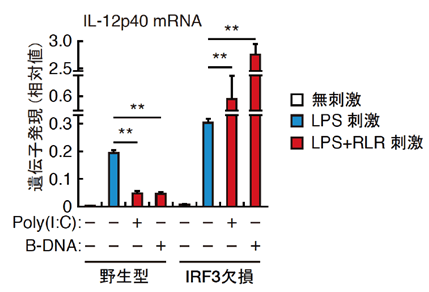
図2 RLR刺激によるIRF3を介したIL-12p40遺伝子の抑制
腹腔マクロファージをTLR刺激(LPS注9))した時のIL-12p40遺伝子の発現と、RLR刺激(poly(I:C)注10)またはB-DNA)した後、さらにTLR(LPS)刺激を行った時のIL-12p40遺伝子の発現を定量的RT-PCR法により解析した。* * p<0.01
野生型において、TLR刺激するとIL-12p40遺伝子の発現が見られるが、RLR刺激した後にTLR刺激をした時はIL-12p40遺伝子の発現が抑制される。
IRF3を欠損したマウスではIL-12p40遺伝子の誘導が増強され、RLR刺激した後にTLR刺激をした時はIL-12p40遺伝子の発現が抑制されず、さらに増強された。
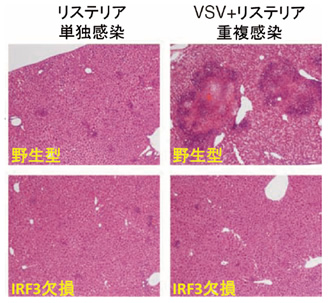
図3 重複感染したマウス肝臓の組織学的分析
野生型またはIRF3欠損マウスにVSVを感染させてから1時間後、さらにリステリアを感染させ、4日後に肝臓を摘出し、パラフィン切片を作成後、HE染色注11)を行った。
VSVとリステリアが重複感染すると、野生型マウスでは激しい組織形態の破壊が起きるが、IRF3を欠損したマウスでは組織破壊が著明に低減した。
<用語説明>
- 注1) RLR
- RIG-I like receptorの略。ウイルスなどに由来する核酸を認識して自然免疫系を活性化させる受容体。
- 注2) TLR
- Toll like receptorの略。種々の病原体を認識して自然免疫系を活性化させる受容体。
- 注3) Th1/Th17細胞
- 活性化ヘルパーT細胞でTh1細胞は細胞内の、Th17細胞は細胞外のバクテリアの排除に関与する。また自己免疫疾患の発症にも関与する。
- 注4) Th2細胞
- 活性化ヘルパーT細胞の一種。抗体たんぱく質の産生やアレルギー性疾患の発症に関与する。
- 注5) VSV
- 水疱性口内炎ウイルス(vesicular stomatitis virus)の略。
- 注6) リステリア
- リステリア属に属する真性細菌の総称で8種類ある。本研究で用いたリステリア・モノサイトゲネスはリステリア属の基準種で、ヒトに対する病原性を持つ。
- 注7) B-DNA
- B-form DNAの略。ウイルス感染時に活性化するRLR経路のリガンド(特定の受容体に特異的に結合する物質)として使用。
- 注8) CpG-B
- 非メチル化CpGオリゴヌクレオチド Bタイプの略。バクテリアゲノムに多く含まれる構造。TLR9のリガンド。
- 注9) LPS
- リポポリッサカライドの略。バクテリアの細胞壁の構成成分。TLR4のリガンド。
- 注10) poly(I:C)
- polyinosine-polycytidylic acidの略。ウイルス感染時に活性化するRLR経路のリガンドとして使用。
- 注11) HE染色
- ヘマトキシン・エオシン染色の略。細胞核、細胞質を染色する。組織形態の観察に用いられる。
<参考文献>
“Cross-interference of RLR and TLR signaling pathways modulates antibacterial T cell responses”
(RLR/TLRシグナル経路間の干渉による抗バクテリアT細胞応答の制御)
<お問い合わせ先>
<研究に関すること>
研究者 谷口 維紹(タニグチ タダツグ)
根岸 英雄 (ネギシ ヒデオ)
東京大学 生産技術研究所 分子免疫学分野
(5月まで)〒113-0033 東京都文京区本郷7-3-1 医学部教育研究棟10F 免疫学講座
(6月以降)〒153-8505 東京都目黒区駒場4-6-1 56号館4~5F 分子免疫学分野
Tel:03-5841-3375(6月以降変更) または 03-5841-3378
Fax:03-5841-3450(6月以降変更)
E-mail:5月まで(tada@m.u-tokyo.ac.jp) または(hnegishi@m.u-tokyo.ac.jp)
6月以降(tada-t@iis.u-tokyo.ac.jp)
※ 教室の移転作業の状況によって、連絡先の変更時期が変わる可能性があります。メール連絡の際は両方のアドレスにお送り下さい。
<JSTの事業に関すること>
事業担当者 石井 哲也(イシイ テツヤ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: