本研究成果のポイント
- ケトンの炭素をゲルマニウムに置換したヘビー級ケトン「ゲルマノン」を初めて合成
- ケトンとは反応しない二酸化炭素が、ゲルマノンとは反応して環状化合物を生成
- 新しい化学反応・触媒反応の開拓と新たな機能性物質デザインの可能性を開く
独立行政法人 理化学研究所(野依 良治 理事長)は、安定な有機化合物であるケトン注1)の炭素原子をゲルマニウム(Ge)に置換したヘビー級ケトン「ゲルマノン」の合成・単離に初めて成功し、ケトンにはない反応性を見いだしました。これは理研基幹研究所(玉尾 皓平 所長)機能性有機元素化学特別研究ユニットの玉尾 皓平 ユニットリーダー、松尾 司副 ユニットリーダー(JST さきがけ「新物質科学と元素戦略」研究者)、李 良春(リ・リアンチュン) 特別研究員らと、先端技術基盤部門物質評価チームの橋爪 大輔 専任研究員、京都大学 大学院工学研究科 分子工学専攻の田中 一義 教授、笛野 博之 助教の研究グループによる成果です。
ケトン(R2C=O、Rは炭素置換基)は化学工業や生態系で中心的な役割を果たす有機化合物で、炭素原子と酸素原子との間に安定した二重結合を形成しています。この炭素(原子量 12.01)を、元素周期表上で同じ列(14族)に属している重い元素のケイ素(Si、原子量28.09)やゲルマニウム(Ge、原子量72.64)に置き換えると、ヘビー級ケトン「シラノン(R2Si=O)」や「ゲルマノン(R2Ge=O)」になります。これらは、化学結合の仕組みを探る基礎科学の面だけでなく、実用化の面でも多くの知見を与えると期待されてきました。しかし、ケイ素やゲルマニウムの不飽和結合注2)が不安定かつ他分子と反応しやすいため、これまでに合成・単離した例はありませんでした。
研究グループは、「Eind(イーインド)注3)」と名付けた立体的に大きな(かさ高い)保護基を独自に開発し、ゲルマニウムと酸素との二重結合を覆った結果、ゲルマノンを合成・単離することに初めて成功しました。ゲルマニウムと酸素の二重結合は、炭素と酸素の二重結合より電荷が分離しており、ゲルマニウムがプラス、酸素原子がマイナスの性質が強いこと、その結果、通常ケトンとは反応しない二酸化炭素が、ゲルマノンとは室温、1気圧で速やかに反応して、環状化合物を生成することを発見しました。
大きく電荷分離したゲルマノンが示す特性は、分子の結合論、反応論に関する基礎的な知見を与えるとともに、ゲルマニウムを用いた小分子の活性化、新たな酸・塩基反応を含む多様な化学反応・触媒反応、機能性物質のデザインなど、幅広い分野に貢献すると期待できます。
本研究成果は、文部科学省 科学研究費補助金 特別推進研究「革新的な汎用性立体保護基の導入による新奇な有機元素化合物の構築と機能開発(研究代表者:玉尾 皓平、研究分担者:松尾 司、田中 一義)」の一環として行われ、科学雑誌『Nature Chemistry 』オンライン版(3月25日付け:日本時間3月26日)に掲載されます。
1.背景
有機化学では、元素周期表の第2周期にある炭素(C)、窒素(N)、酸素(O)などが中心的な役割を果たしており、それらの元素の間で二重結合や三重結合などの不飽和結合が安定に形成されます。中でもケトン(R2C=O)は、炭素原子と酸素原子との二重結合を持ち、その炭素原子上に2つの炭素置換基(R)が結合した有機化合物群の総称で、化学工業や生態系など私たちの身の周りで機能している基本物質の1つです(図1)。例えば、マニキュアの除光液に使われるアセトンは最も小さくて軽いケトンですし、炭素グループ上での炭素-炭素結合反応やアルコールへの変換などでも極めて有用な反応基質です。
周期表で炭素(第2周期、原子量12.01)の下に位置するのがケイ素(Si:第3周期、原子量28.09)やゲルマニウム(Ge:第4周期、原子量72.64)です。原子量が炭素より大きいので、重い元素といえます。炭素が生命体を構成する有機物の構成元素であるのに対し、ケイ素は岩石や砂といった地殻の主要元素でガラス産業やエレクトロニクス産業を支え、ゲルマニウムはダイオードや光検出器などに用いられている無機物の構成元素です。これらケイ素やゲルマニウムなど第3周期以降の元素の不飽和結合は極めて不安定で、30年前までは存在さえもしないとされてきました。例えば、二酸化炭素(CO2)と二酸化ケイ素(SiO2)を比べると、二酸化炭素は炭素原子と酸素原子間に2つの二重結合を有する安定な直線型の気体分子(O=C=O)であるのに対し、二酸化ケイ素はどこにも二重結合を含まず、ケイ素原子と酸素原子が単結合で無限につながった固体物質(岩石、砂)です。これは、ケイ素原子と酸素原子の二重結合が極めて不安定であることに起因しています。
1981年、米国ウィスコンシン大学の研究者らが、かさ高い「立体保護基」を用いて反応性の高い二重結合を外敵の攻撃から守り(他の分子と反応するのを防ぎ)、ケイ素原子間の二重結合(Si=Si)を持つ化合物「ジシレン」を初めて安定に合成しました。それ以来、さまざまな立体保護基を用いて、高周期元素による不飽和結合の化合物合成が試みられてきました。中でも、ケトンの炭素原子をケイ素原子やゲルマニウム原子に置換した重いケトン(ヘビー級ケトン)である「シラノン(R2Si=O)」や「ゲルマノン(R2Ge=O)」(図1)は、化学結合の仕組みを探る基礎科学の面から注目される分子であるため、20世紀初頭から世界中の研究者がその合成に挑戦してきました。しかし、Si=OやGe=Oの二重結合が極めて不安定かつ反応活性であるため、適切な「立体保護基」がなかなか見つかりませんでした。
2011年に研究グループは、独自に開発したかさ高い立体保護基「EMind(炭素原子24個と水素原子37個)」を利用して、4つのケイ素原子でできた環状化合物「テトラシラシクロブタジエン」の合成に成功しています(2011年3月11日プレス発表:
http://www.riken.jp/r-world/info/release/press/2011/110311_2/index.html)。今回、ヘビー級ケトン「ゲルマノン」の合成・単離を目指し、カギとなる適切な大きさの立体保護基の設計に挑みました。
2.研究手法と成果
研究グループは、炭素原子28個と水素原子45個からなる巨大原子団で、「Eind(イーインド)」と名付けたかさ高い立体保護基をゲルマニウム原子に2個つなげたところ、ゲルマニウムと酸素との二重結合を保護することに成功し、「ゲルマノン」の合成・単離を実現しました。Eind基は、市販の化成品を出発原料にして3段階の反応で大量合成することが可能です。2個のEind基をゲルマニウムにつなげた「ゲルミレン」を基にゲルマノンを合成し(図2)、低温(-30℃)の環境下で再結晶させたところ、単離収率78%でゲルマノンの無色透明な結晶を取り出すことができました(図3)。
ゲルマノンの分子構造をX線で解析したところ、ゲルマニウムを中心に2個のEind基の炭素原子と1個の酸素原子が配置されていました。ゲルマニウム周りの結合角の和がほぼ360度であることから、これら4個の原子が同一平面上にあることが分かりました(図4)。また、ゲルマニウムと酸素との結合長は1.6468オングストローム(Å)で、単結合長(1.76Å)よりも短く、二重結合を形成しているものと理解できます。
さらに、Eind基を炭素6個と水素5個のフェニル基注4)に単純化して電荷の分布を計算すると、ケトンよりもゲルマノンの方が電荷が分離しており、ゲルマニウム原子のプラスと酸素原子のマイナスの性質がより高まっていることが分かりました(図5)。これは、炭素と酸素との二重結合と比べて、ゲルマニウムと酸素との二重結合が弱く、電子がゲルマニウムから酸素の方に流れ込みやすくなっているためであると考えられます。
ゲルマノンの合成・単離に成功したため、その反応性を実際に調べました。その結果、ゲルマノンはケトンと同様の反応性を示す一方で、ケトンとは通常反応しない分子と反応することも見いだしました。具体的には、ゲルマノンはケトンと同様に還元されてアルコールへ変換可能である一方で、触媒などが必要なケトン同士の反応が、ゲルマノンとケトン(アセトン)では無触媒で反応することを見いだしました。また、ケトンと反応しない二酸化炭素がゲルマノンとは容易に反応して、ゲルマニウム-酸素-炭素結合を含む環状化合物を生成することも見いだしました(図5)。これらは、ゲルマノンの酸素原子がケトンの酸素原子よりも電子が豊富でマイナスの性質が強いことによるものと理解できます。
3.今後の期待
これまで合成することができなかったヘビー級ケトン「ゲルマノン」を手に入れたことにより、今後はケイ素原子でできた「シラノン」の合成研究も加速すると予想されます。ゲルマノンやシラノンを詳細に調べることで、化学結合の仕組みを探る分子の結合論、反応論に関する基礎的な知見が得られ、新しい化学反応・触媒反応の開拓や機能性物質の設計などに活用されると考えられます。
特に、プラスとマイナスに大きく電荷が分かれた構造は、小分子の活性化や全く新しい酸・塩基反応などにつながる可能性を秘めており、幅広い分野に貢献すると期待できます。
4.研究サポート
本研究は、文部科学省 科学研究費補助金 特別推進研究「革新的な汎用性立体保護基の導入による新奇な有機元素化合物の構築と機能開発(研究代表者:玉尾 皓平、研究分担者:松尾 司、田中 一義)」と、一部JST 戦略的創造研究推進事業 さきがけ「新物質科学と元素戦略」領域の研究課題(研究者:松尾 司)の一環として行われました。
<原論文情報>
Liangchun Li, Tomohide Fukawa, Tsukasa Matsuo, Daisuke Hashizume, Hiroyuki Fueno, Kazuyoshi Tanaka, Kohei Tamao
“A stable germanone as the first isolated heavy ketone with a terminal oxygen atom”
Nature Chemistry, 2012, DOI: 10.1038/NCHEM.1305
doi: 10.1038/nchem.1305
<参考図>
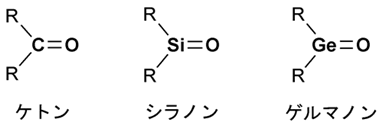
図1 ケトン、シラノン、および、ゲルマノンの化学構造(Rは炭素置換基)
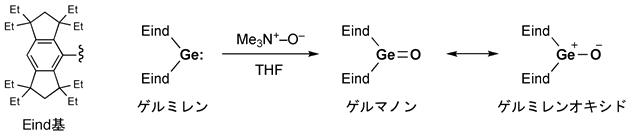
図2 ゲルマノンの合成
Eind基、ゲルミレン、ゲルマノンと電荷が分離したゲルミレンオキシドの化学構造。
生成したゲルマノンは電荷が分離したゲルミレンオキシドの寄与がある。
図3 ゲルマノンの結晶の写真
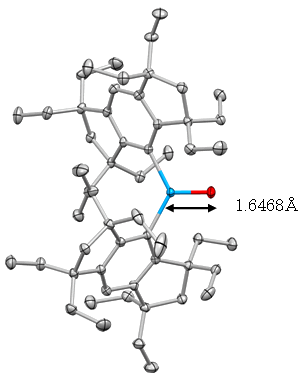
図4 X線で解析したゲルマノンの分子構造
ゲルマニウム原子(水色)、酸素原子(赤)、Eind基の炭素原子(灰色)の位置を示す。ゲルマニウム原子と酸素原子と2個のEind基の炭素原子は同一平面上にある。ゲルマニウム原子と酸素原子間の結合長(青と赤)は、1.6468Åだった。
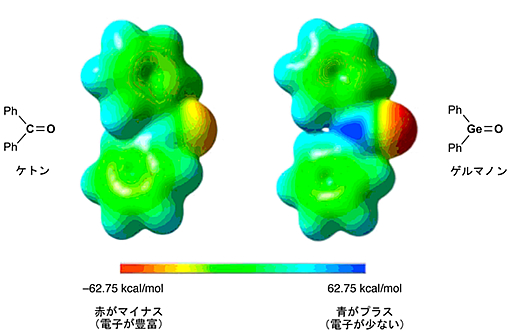
図5 ケトン(左)とゲルマノン(右)の電荷分布の様子(静電ポテンシャル図)
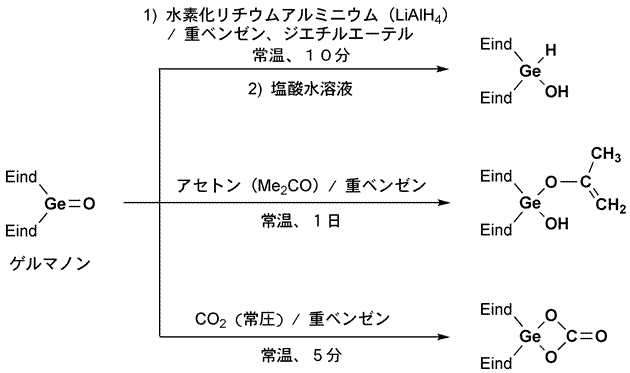
図6 ゲルマノンの還元反応、ケトンとの反応、二酸化炭素との反応例
ケトンと同様の反応例(上)とケトンと異なる反応例(中、下)。
- 上:ゲルマニウム-酸素二重結合が還元されて、アルコール(OH)に変換された。
- 中:ゲルマノンとアセトン(Me2CO)の反応が、常温、1日、無触媒で進行した。
- 下:ゲルマノンと二酸化炭素の反応が、常温、5分で進行し、環状化合物を生成した。
<補足説明>
- 注1) ケトン
- ケトンは、R2C=Oの構造式で表される有機化合物の総称(Rは炭素置換基)。炭素原子と酸素原子との二重結合(C=O)を有しており、これはカルボニル基と呼ばれる。Rとしてメチル基が置換した最も単純なケトンがアセトン(Me2C=O)であり、マニキュアの除光液として用いられる。通常ケトンは単量体(モノマー)として存在する。
- 注2) 不飽和結合
- 隣接する原子間で2価以上で結合している化学結合。不飽和結合を持つ化合物を不飽和化合物と呼び、二重結合や三重結合などの多重結合を有する。不飽和化合物は、シグマ結合だけからなる飽和化合物とは異なり、シグマ結合に加えてパイ結合を形成している。
- 注3) Eind(イーインド)
- 1,1,3,3,5,5,7,7-octaethyl-s-hydrindacen-4-yl の略。分子式C28H45の巨大な炭化水素の置換基。ベンゼン環を基本とするアリール基の一種。
- 注4) フェニル基
- ベンゼンの1つの水素を取り去ってできる置換基。C6H5あるいはPhと表記する。
<報道担当・問い合わせ先>
(問い合わせ先)
理化学研究所 基幹研究所 機能性有機元素化学特別研究ユニット
玉尾 皓平(タマオ コウヘイ) ユニットリーダー
Tel:048-467-9894 Fax:048-467-9895
松尾 司(マツオ ツカサ) 副ユニットリーダー
Tel:048-462-4994 Fax:048-462-4995
(報道担当)
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
科学技術振興機構 広報ポータル部
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: