JST 課題達成型基礎研究の一環として、京都大学 大学院医学研究科の小林 拓也 講師らは、認知症や心機能の抑制に関係するヒトのムスカリン受容体の立体構造をX線結晶構造解析注1)によって解明しました。
パーキンソン病やアルツハイマー病は、神経伝達物質の1つであるアセチルコリン注2)の脳内バランスが崩れることで発病します。アセチルコリンと結合する受容体(アセチルコリン受容体)は、ニコチン受容体とムスカリン受容体の2つに大別され、その中でもムスカリン受容体は5種類のサブタイプに分類されますが(M1からM5まで)、いずれもGたんぱく共役受容体(GPCR)注3)と呼ばれる膜たんぱく質として知られており、創薬の標的として世界中から注目されています。しかしながら、膜たんぱく質は疎水性であり結晶化しにくく、X線結晶構造解析のための試料作成が困難であるため、ヒトのGPCRの立体構造もこれまでに数個しか解析されていません。
本研究ではまず、昆虫細胞を用いることで、ヒトのムスカリンM2受容体の大量発現に成功し、リガンド結合活性注4)のある受容体だけを単一に精製しました。さらに、高純度に精製されたムスカリンM2受容体は、膜たんぱく質に適した脂質立方相法注5)を用いて結晶化され、X線結晶構造解析によって世界で初めて立体構造を明らかにしました。また、ムスカリンM2受容体と抗コリン薬注6)の複合体の立体構造の解析も行うことで、抗コリン薬の結合様式や、ムスカリンM2受容体に特有なアミノ酸に囲まれた薬剤結合部位の存在も明らかにしました。
本研究により、薬の標的の「形」が原子レベルで明らかになったことで、今後、その立体構造情報をもとに、より効果的で副作用のないパーキンソン病や統合失調症の治療薬の探索・設計が可能になると期待されます。
本研究は、学習院大学の芳賀 達也 前 教授や米国のスタンフォード大学のブライアン・コビルカ 教授との共同研究で行われ、本研究成果は、2012年1月25日(英国時間)に英国科学雑誌「Nature」のオンライン速報版で公開されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
| 研究プロジェクト |
「岩田ヒト膜受容体構造プロジェクト」 |
| 研究総括 |
岩田 想(京都大学 大学院医学研究科 教授) |
| 研究期間 |
平成17~23年度 |
JSTはこのプロジェクトで、構造解析の極めて困難な疎水的な膜たんぱく質であるヒト膜受容体の構造解析において、膜受容体の精製・結晶化の普遍的な技術および、ヒト膜受容体構造解析を系統的に行う技術の確立を目指し、研究を推進しました。
<研究の背景と経緯>
アセチルコリンは、世界で最初に神経伝達物質の1つであることが証明された物質です。アセチルコリンには、ニコチン作用とムスカリン作用が存在することが古くから知られており、各々に特異的なアセチルコリン受容体(ニコチン受容体とムスカリン受容体)が同定されています。副交感神経や運動神経の末端から分泌されたアセチルコリンは、骨格筋、内臓平滑筋などに存在するアセチルコリン受容体に働き、筋収縮を促進するほか、副交感神経を刺激し、心拍数の減少、脈拍数の減少、唾液の分泌を促進します。このようにアセチルコリンは、基本的な生命現象に深く関与しています。
特に、脳内のアセチルコリンのバランスが崩れるとさまざまな疾患が生じます。例えば、アセチルコリンが減少すると自律神経失調症やアルツハイマー病につながると言われています。また、パーキンソン病の患者では、アセチルコリンの相対的な増加が認められます。アセチルコリンがムスカリン受容体に結合するのをブロックすることで、パーキンソン病の症状を緩和することが知られており、古くから治療薬として使われています。一方で、副作用として統合失調症や認知症の症状を悪化させることも知られています。
ムスカリン受容体には、5種類のサブタイプ(M1からM5まで)が存在しています。例えば、M1受容体は大脳皮質や海馬に多く存在し、記憶や学習に関与していると考えられています。また、M2受容体は主に心臓に分布し、心臓機能を抑制的に調節しています。このように各々のサブタイプは固有の分布と薬理作用を持っており、構造に指南されたサブタイプ選択的な創薬が期待されています。
しかし、膜たんぱく質であるムスカリン受容体は、可溶性の細胞内のたんぱく質と異なり、立体構造を明らかにするために必要なたんぱく質の精製や結晶化が非常に困難なため、これまで立体構造が解明されていません。そこで、研究グループでは、より効果的で副作用の少ない薬剤の探索・設計に有効なムスカリン受容体の構造情報を得るために、受容体の発現・精製から結晶解析までのさまざまな技術開発と立体構造の解明を試みました。
<研究の内容>
本研究では、まずヒトのムスカリンM2受容体遺伝子を合成し、昆虫細胞を用いることで、安定な受容体を大量に発現することに成功しました。また、リガンドアフィニティーカラム(特定の分子と親和性のあるたんぱく質のみを固定して精製する方法)を用いて、リガンド結合活性のある受容体だけを単一に精製することで、ムスカリンM2受容体の結晶化が可能となりました。ムスカリンM2受容体は、膜たんぱく質の結晶化で効果を上げている脂質立方相法を用いて結晶化を行い、X線結晶構造解析によって抗コリン薬の1つである3-キヌクリジニルベンジラート(3-quinuclidinyl benzilate:QNB)とムスカリンM2受容体の複合体の立体構造を解明しました(図1a、b)。
ムスカリンM2受容体の全体構造は、これまでに構造が決定されているGPCRと同様に7本の膜を貫通したらせん構造を持っていました。QNBは、ムスカリン受容体の5種類全てのサブタイプに共通して存在するアミノ酸に囲まれていました(図2a、b)。また、受容体に結合したQNBに3つの大きなアミノ酸(チロシン残基)がふたのように覆いかぶさっていることから、一度受容体に結合したQNBが受容体から離れにくくなっていることが分かりました(図2c)。
QNBは、アセチルコリンが結合するオルソステリック部位注7)に結合していることが示されましたが、アロステリック部位注8)はその上部に比較的広い空間として細胞の外側に広がっていました(図3)。アロステリック部位を構成するいくつかのアミノ酸は、アミノ酸変異実験によりアロステリック部位に結合するリガンドの親和性が低下することが報告されているアミノ酸残基と一致していました。アロステリック部位は、各受容体サブタイプにおいて特徴的なアミノ酸残基が存在している部位です。従って、各サブタイプに特徴的なアミノ酸残基の側鎖と化合物の官能基の間に相互作用(水素結合など)を生み出すことができ、サブタイプ選択的な化合物の開発につながると考えられます。
<今後の展開>
創薬分野では近年、たんぱく質の立体構造をもとにした創薬戦略(Structure-Based Drug Design)が進められています。特に、ヒトが持つ受容体は創薬のターゲットとして注目されており、これらの受容体の立体構造を明らかにすることで、より効果的な薬剤の設計が可能になると期待されています。
本研究からムスカリンM2受容体の立体構造が明らかとなり、抗コリン薬の結合部位の詳細情報を得ることができました。これらの立体構造の情報をもとに、今後、より効果的で副作用のない各受容体サブタイプ選択的な薬の探索・設計が可能になると考えられ、パーキンソン病、アルツハイマー病、統合失調症などの治療薬への貢献が期待されます。
<参考図>
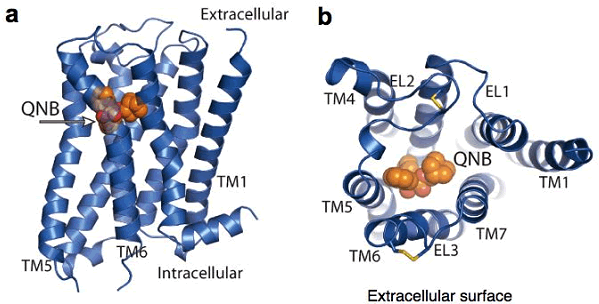
図1 ムスカリンM2受容体とQNB複合体の立体構造
-
a) 全体構造を横から見たもの。QNBをオレンジ色で表示している。QNBが、細胞内(Intracellular)よりも細胞外(Extracellular)側に結合している。
-
b) 全体構造を細胞の外側から見たもの。QNB(オレンジ色)が、7つの細胞膜を貫通しているらせん構造(TM1~7)に囲まれている。TMは3つの細胞外のループ構造(EL1~3)でつながっている。
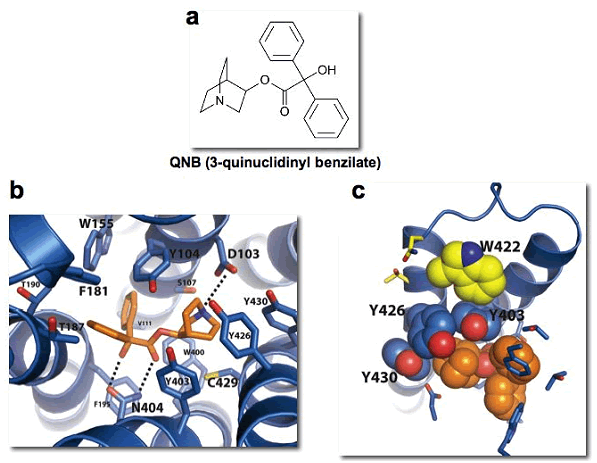
図2 リガンド結合部位の様子
- a) QNBの構造式。
-
b) QNB(オレンジ色)と周囲のアミノ酸(青色)の相互作用。周囲のアミノ酸のほとんどのものが、M2以外のムスカリン受容体サブタイプでも保存されている。
-
c) 結合しているQNBにふたのように覆いかぶさっているチロシン残基(Y403、Y426、Y430)。トリプトファン残基(W422、黄色)はアロステリックリガンドの結合に関与していることが示唆されているアミノ酸。
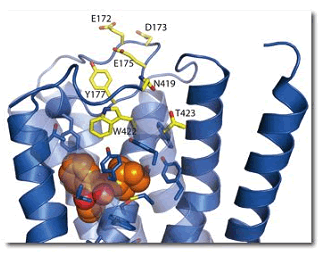
図3 アロステリック部位の様子
オルソステリック部位を構成するアミノ酸(青色)とその上にアロステリック部位を構成するアミノ酸(黄色)が存在する。
<用語解説>
- 注1) X線結晶構造解析
- 解析対象のたんぱく質を結晶化し、X線照射によって得られる回折データから、結晶内部で原子がどのように配列しているかを決定する手法。
- 注2) アセチルコリン
- 副交感神経や運動神経の末端から放出され、刺激を伝える神経伝達物質。中枢神経系にも存在する。
- 注3) Gたんぱく共役受容体(GPCR:G protein coupled receptor)
- 細胞の増殖や分化の制御や細胞内物質輸送などさまざまなものに関わっているGたんぱく質(グアニンヌクレオチド結合たんぱく質)と共役して、細胞外の情報を細胞内へ情報伝達する受容体ファミリー。多くの薬の標的となっている。
- 注4) リガンド結合活性
- 特定の受容体に結合する分子(基質:リガンド)が、受容体に結合する働きのこと。
- 注5) 脂質立方相(Lipidic cubic phase)法
- 脂質(モノオレインなど)からなる脂質二重層内にたんぱく質を存在させ、生体膜に近い環境で結晶化を行う方法。膜たんぱく質の結晶化に有効な手法。
- 注6) 抗コリン薬
- アセチルコリンがアセチルコリン受容体に結合することを阻害する薬のこと。有機リン剤中毒などの治療に用いられたアトロピンなどがある。
- 注7) オルソステリック部位
- 受容体の基質(内在性リガンド)が結合する場所。ムスカリン受容体の場合、アセチルコリンの結合する場所を意味する。
- 注8) アロステリック部位
- 受容体の基質(内在性リガンド)が結合する場所とは異なる場所で、そこに結合する物質によって受容体機能が影響を受ける場所。近年、アロステリック制御因子(リガンド)は新しいクラスの医薬品として注目されている。
<論文名>
“ Structure of the human M2 muscarinic acetylcholine receptor bound to an antagonist ”
(アンタゴニストの結合したヒトのムスカリン性アセチルコリン受容体M2サブタイプの立体構造)
doi: 10.1038/nature10753
<お問い合わせ先>
<研究に関すること>
小林 拓也(コバヤシ タクヤ)
京都大学 大学院医学研究科 分子細胞情報学 講師
〒606-8501 京都府京都市左京区吉田近衛町
Tel:075-753-4389 Fax:075-753-4660
E-mail:
芳賀 達也(ハガ タツヤ)
学習院大学 理学部 生命科学研究科 前 教授
〒171-8588 東京都豊島区目白1-5-1
E-mail:
<JSTの事業に関すること>
金子 博之(カネコ ヒロユキ)
科学技術振興機構 イノベーション推進本部 研究プロジェクト推進部
〒102-0075 東京都千代田区五番町7 K’s五番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: