JST 課題達成型基礎研究の一環として、東京大学 大学院医学系研究科の浦野 泰照 教授と米国国立衛生研究所(NIH)の小林 久隆 主任研究員は、外科手術時や内視鏡・腹腔鏡施術時に、がんの存在が疑われる部分にスプレーするだけで、1分前後でがん部位のみを鋭敏に検出できる試薬の開発に成功しました。
現在、PETやMRIなどの原理に基づくがん診断法が医療現場で利用されていますが、これらの手法では1cm以下の微小がんの検出は困難です。しかし、がんの再発を防ぐには、例えば、腹腔内に転移した1mm程度の微小がんを検出し、これを全て取り除くことが非常に重要です。現状では、特殊な光学系を採用した内視鏡などを用いて、手術者自身の経験に基づいてくまなく探す以外に方法がなく、微小がん部位の見落としや取り残しが大きな問題となっていました。
このようにがん手術の臨床現場では、微小がん部位の適確な検出法の確立が強く求められていました。今回研究者らは、がん細胞が持つ特殊な酵素活性を鋭敏に検出し、がん部位のみに強い蛍光色を付ける試薬の開発に成功しました。この試薬を溶解した水溶液をがんが疑われる部位に少量スプレーするだけで、数十秒~数分程度で手術者の目でも直接確認できるほどの強い蛍光が、がん部位から観察されることを、がんモデル動物を用いた実験で証明しました。このような局所散布による、短時間での鋭敏ながん部位可視化技術は、ほかに例のない世界初の技術です。
本研究成果は、外科手術時や近年実施例が急増している内視鏡・腹腔鏡下施術において、微小がん部位の発見や取り残しを防ぐ画期的な技術として、臨床応用が期待されるものです。現在、浦野教授を研究代表者とするJST 研究加速課題において、東京大学医学部附属病院、がん研究会有明病院、NIHと協同して、この蛍光試薬の効果の検証を患者体内から取り出したばかりのがんサンプルを用いて行っています。
本研究成果は、2011年11月23日(米国東部時間)発行の米国の医学科学誌「Science Translational Medicine」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 研究加速課題
| 研究課題名 |
「光機能性プローブによるin vivo微小がん検出プロジェクト」 |
| 研 究 者 |
浦野 泰照(東京大学 大学院医学系研究科 教授) |
| 研究期間 |
平成22年1月~平成26年12月 |
上記研究課題では、モデルマウスでの成果・実績をもとに、開発した有機プローブ分子をヒトのがん診断に臨床応用するための基礎データ(前臨床データ)を収集するとともに、新たな有機プローブ分子の開発を行う研究を加速します。
<研究の背景と経緯>
がんは、早期発見・治療が重要な疾患です。転移する前であれば原発巣(げんぱつそう)を、転移後であっても転移微小がんを完全に取り除くことで、患者の予後は劇的に改善します。治療法も近年では、開腹を必要とする外科手術から、より負担の少ない内視鏡・腹腔鏡を用いた摘出術へのシフトが加速しており、除去すべきがん部位を手術者に正確に把握させる技術、すなわち、がん部位の精密検出法の確立が強く求められています。
がんの検診法としては、PET検診、MRI検査、X線CT検査などが現在広く用いられていますが、これらの技法によって検出できるがんの大きさは1cm程度が限界で、数mmサイズのがんを見つけることは極めて難しいのが現状です。また、放射線被ばくの問題や大がかりな高額装置が必要である点も、医療技術の一般への普及を考える上で問題点として指摘されています。
このような背景のもと、光を活用したがん部位検出法、特に蛍光法に基づくがん部位検出技法は、その感度の高さや安全性、装置の簡便さなどの点から近年大きな注目を集めています。東京大学の浦野教授とNIHの小林主任研究員らは2009年に、動物体内にできた微小がんを特異的に蛍光検出する技術の開発に成功しました(2009、Nature Medicine)。これは、現在がん治療薬として広く用いられている、がん抗体を利用する技術で、動物体内に投与すると数時間程度で、がん部位を選択的に光らせることが可能な画期的な新技術でした。しかし、がん部位が光るまでに数時間以上の長い時間を要する点と、最終的にがん部位が持つ蛍光は微弱で、特殊な装置を活用しないと検出しにくい点が問題点として残っていました。今回開発した技術は、全く発想の異なる切り口でこの両者を克服し、数十秒~数分程度の短時間で、目で見えるほどに明るくがん部位が蛍光を発するようになる画期的な世界初の技術であり、がん医療に直接貢献できる可能性の極めて高い技術です。
<研究の内容>
今回開発したがん部位検出技術は、「有機小分子蛍光プローブ注1)」と呼ばれる生体内の物質を可視化するための蛍光色素を極めて少量患部にスプレーするだけで、がん部位を高選択的に光らせる技術です。
がん部位を見分ける鍵となるがん細胞の特徴として、今回はγ-グルタミルトランスペプチダーゼ(γ-glutamyl transpeptidase:GGT)注2)という酵素に着目しました。この酵素は、肺がんや肝臓がん、乳がん、脳腫瘍、卵巣がん、子宮頸がんなど、多くのがん組織でその活性が増強しているという報告がある酵素で、グルタチオンという細胞活動に重要な分子を生合成する役割を持っています。
今回浦野教授は、自身が確立したオリジナル蛍光プローブ設計法に基づき、生きている細胞のGGT活性を可視光(緑色)蛍光として検出する世界初の蛍光プローブ試薬を開発しました。このプローブ試薬は、それ自身は無色・無蛍光な分子ですが、GGTと出会うことで強い緑色蛍光を発する分子へと変化する機能を持っており、GGT活性を持つ細胞を選択的かつ鋭敏に、短時間で蛍光染色できる画期的な試薬です(図1)。小林主任研究員は、このプローブ試薬をさまざまながんモデルマウスに適用し、微小がん検出試薬としての機能を詳細に検討しました。その結果、がんの存在が疑われる部位にプローブ試薬を散布すると、1mm以下の微小がんであってもわずか数十秒~数分程度で、明確にこれを検出できることが分かりました(図2)。さらに蛍光内視鏡下でがんモデルマウス体内のがん部位を可視化し、これを鉗子を用いて除去する模擬手術にも成功しました。
本プローブ試薬を散布することで、微小がん部位は非常に強く光るようになり、その蛍光は蛍光内視鏡で捉えられるのはもちろんのこと、人間の目でも十分に確認できることも明らかとなりました。本プローブ試薬は、このように極めて鋭敏ながん部位検出を可能とするため、患部を直接眼前で見る外科手術時にも、微小がん部位の発見や、取り残しを防ぐなどの大きな効果を発揮するものと期待されます(図3)。
以上のような、微少量のプローブ試薬の噴霧により、数十秒~数分程度の短時間で、目で捉えられるほど強い蛍光をがん部位に付与できる技術は、ほかに例を見ない世界初の検出技術です。
<今後の展開>
本研究成果は、外科手術時や近年実施例が急増している内視鏡・腹腔鏡下施術において、微小がん部位の発見や取り残しを防ぐ画期的な技術として、その臨床応用が強く期待されるものです。また蛍光検出機器は非常に安価であるため、今回のがん部位可視化技術は多くの医療機関に広がりうる可能性を持っており、医療経済の観点からも重要な成果と考えています。
現在、浦野教授を研究代表者とするJST 研究加速課題において、東京大学医学部附属病院とがん研究会有明病院と協同して、この蛍光プローブ試薬の効果の検証を、患者体内から取り出したばかりのがんサンプルを用いて行っています。またNIHの小林主任研究員とも共同して、米国で卵巣がん摘出サンプルを用いた検証も行います。
一方で、今回ターゲットとして利用しているGGTをほとんど発現していないがん細胞種もいくつか存在するため(大腸がん、卵巣がん、胃がんのそれぞれ一部のがん細胞)、これらのがんは今回開発したプローブ試薬では検出できません。現在このようながん組織の可視化を実現する新たなプローブ試薬の開発も行っており、将来的には、ほとんどのがん部位を短時間に、鋭敏に検出できるようになるものと期待しています。
<付記>
今回の成果は、浦野教授を中心とする東京大学 大学院医学系研究科・薬学系研究科グループと小林主任研究員を中心とするNIHグループの共同成果です。
<参考図>
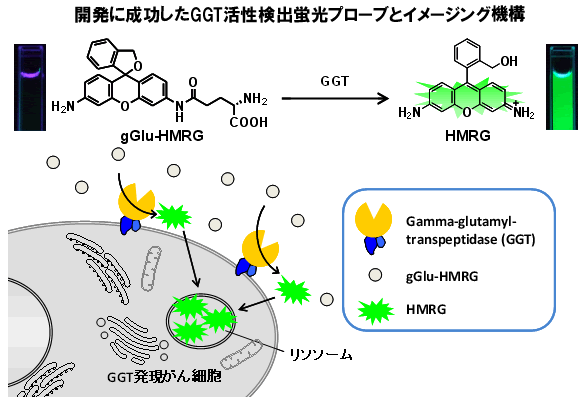
図1 開発に成功したGGT検出蛍光プローブ試薬gGlu-HMRGと、
この試薬活用によるがん細胞イメージング機構
gGlu-HMRGプローブそれ自身は無蛍光であるため、細胞外から散布しても当初は蛍光は観察されない。GGTを高発現しているがん細胞に出会うと、細胞膜表面上のGGTによる反応が起こり、強い蛍光を発するHMRGが生成する。HMRGは容易に細胞膜を通過し、細胞内のリソソームに主に蓄積するため、がん細胞だけを特異的に蛍光染色できる。
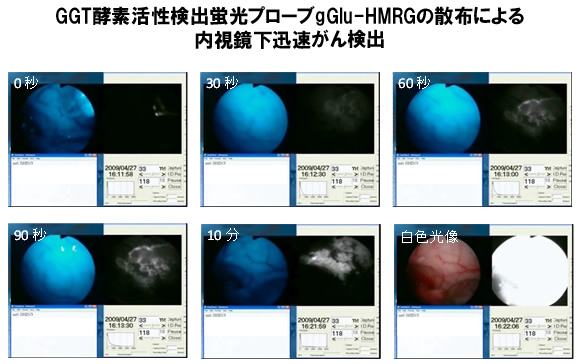
図2 蛍光内視鏡下噴霧による、短時間での微小がん部位検出の実現
(卵巣がんが腹膜に転移した腹膜播種モデルマウス)
生きている状態のがんモデルマウスを麻酔し、腹腔内に直径4.6mmの小型内視鏡を挿入してがんイメージングを行った。まずがんの存在が疑われる部位へ、内視鏡の先端からプローブ試薬を散布した。患部の近辺の蛍光時間変化を各図の右側の白黒画像で示した。1mm程度の微小がんであっても、30秒程度で蛍光の増大が観測され、1分後には正常部位とがん部位とを明確に区別できることが明らかとなった。
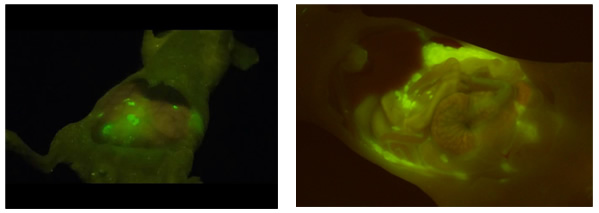
図3 がん部位の蛍光検出画像
開腹手術時にプローブ試薬を散布するだけで、1分程度でがん部位が強く蛍光を発するようになるため、目視による微小がん部位の発見も可能である(卵巣がん腹膜播種モデルマウス)。
<用語解説>
- 注1) 蛍光プローブ
- 元々は無蛍光であるが、検出対象分子の存在下ではその構造が変化して、強い蛍光を発するようになる分子。蛍光プローブを導入した細胞を蛍光顕微鏡下で観察することで、生きている状態での細胞内変化を鋭敏に捉えることが可能となる。例えばCa2+イオンに選択的に結合して蛍光を発する蛍光プローブを活用すれば、細胞内Ca2+イオンの変化を時間を追って観察可能となる。
- 注2) γ-グルタミルトランスペプチダーゼ(γ-glutamyl transpeptidase:GGT)
- グルタチオンなどN-末グルタミン酸のγ位のペプチド結合を切断して、他のペプチドのN末端へこれを転移する反応を触媒する酵素。細胞外グルタチオンを分解して、システインとして細胞内に取り込み、細胞内でグルタチオンを再生させることで細胞活動を支えている重要な酵素である。
<論文名>
“Rapid Cancer Detection by Topically Spraying a γ-Glutamyltranspeptidase-Activated Fluorescent Probe”
(新規γ-グルタミルトランスペプチダーゼ検出蛍光プローブの局所散布による迅速がん検出の実現)
doi: 10.1126/scitranslmed.3002823
<お問い合わせ先>
<研究に関すること>
浦野 泰照(ウラノ ヤステル)
東京大学 大学院医学系研究科 生体情報学分野 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3601 Fax:03-5841-3563
E-mail:
URL: http://cbmi.m.u-tokyo.ac.jp
小林 久隆(コバヤシ ヒサタカ)
米国国立衛生研究所(NIH) Molecular Imaging Program, NCI/NIH Chief scientist
Bldg. 10, Room B3B69, MSC 1088,
10 Center Dr., Bethesda, MD 20892-1088
Tel:301-435-4086 Fax:301-402-3191
E-mail:
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)
科学技術振興機構 イノベーション推進本部 研究推進部(研究推進担当)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2063
E-mail: