国立大学法人 京都大学(松本 紘 総長)の研究グループは、マウスで多能性幹細胞であるES細胞注1)とiPS細胞注2)を卵子や精子を作る元となる始原生殖細胞注3)に試験管内で分化させて、それらをもとに健常な精子とその子孫を得ることに成功しました。これは、同校 大学院医学研究科の斎藤 通紀 教授と林 克彦 講師らによる研究成果です。
これまでの研究では、ES細胞やiPS細胞には生殖細胞を含む他の細胞に分化できる能力があると確認されていましたが、ES細胞やiPS細胞から精子などを作り出す始原生殖細胞を体外培養で作製した成功例はなく、その技術開発が望まれていました。
本研究グループは今回、マウスのES細胞やiPS細胞を試験管内で始原生殖細胞に分化させる技術を開発しました。そして、この技術で得た始原生殖細胞を雄マウスの精巣内に移植することで精子を得ることに成功しました。また、それら精子を用いて体外授精することで、健常なマウスを産出できることも明らかにしました。
この体外培養技術により、これまで生体から採取が困難であった始原生殖細胞を体外で多数作製できることから、始原生殖細胞の発生メカニズム解明に貢献するものと期待されます。また、この培養技術を応用することで不妊症の原因究明などにも役立つものと期待されます。
本研究成果は、2011年8月4日(米国東部時間)に米国科学誌「Cell」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「人工多能性幹細胞(iPS細胞)作製・制御等の医療基盤技術」
(研究総括:須田 年生 慶應義塾大学 医学部 教授)
|
| 研究課題名 |
「生殖系列におけるゲノムリプログラミング機構の統合的解明とその応用」 |
| 研究代表者 |
斎藤 通紀(京都大学 大学院医学研究科 教授) |
| 研究期間 |
平成21年度~平成23年度
(平成23年度にERATO型研究として採択)
|
JSTはこの領域で、iPS細胞を基軸とした細胞リプログラミング技術の開発に基づき、その技術の高度化・簡便化をはじめとした研究によって、革新的医療に資する基盤技術の構築を目指しています。上記研究課題では、生殖細胞の初期発生過程に随伴するゲノムリプログラミング過程の本態を高解像度で解明し、ゲノムリプログラミングを引き起こす分子機序を解明、試験管内で再構成することを目指しています。
<研究の背景と経緯>
マウスやヒト体細胞からiPS細胞を作製したことは、発生・細胞・幹細胞生物学分野に衝撃を与え、また再生医学領域の大きな前進に貢献しつつあります。iPS細胞作製効率の改善や、ベクターのゲノムへの組込みを伴わない、より安全なiPS細胞作製技術の開発などの分野は急速に進展しており、これまでにさまざまな新技術が創出されています。今後は、iPS細胞を高い効率で再現性よく、医学的に有用な細胞に分化させる技術の開発がさらに重要になると考えられます。
一方で、体細胞を分化前のiPS細胞に戻す(リプログラミング)分子機構に関しては、多くの点が未解明です。このリプログラミング過程に関与する分子機構をより詳細に解明することは、iPS細胞作製のさらなる効率化・簡便化につながると考えられます。生殖細胞系列は、ヒトを含む多細胞生物を構成する生体内の細胞系譜の中で、最も細胞の多能性や細胞リプログラミングに深く関連するものであると考えられます。また、生体における細胞系譜分化・機能維持機構の正確な理解と、それらの過程を規定するエピゲノム注4)状態の測定を可能にすることは、この研究分野を発展させうる基礎になると言えます。
これらの背景を考慮すると、ES細胞やiPS細胞といった多能性幹細胞から生殖細胞系列の細胞を作製・培養できれば、両者の関連性をより明らかにすることができ、基礎・応用の両面から大きな波及効果もあると見込めます。本研究グループでは、生殖細胞系譜分化・機能維持機構を正確に理解し、それらの過程を規定するエピゲノム状態を測定してゲノムリプログラミングの詳細な分子機構を解明することで、細胞リプログラミング技術の発展に貢献することを目標として研究を進めてきました。
<研究の内容>
本研究では、マウスの発生において生殖細胞が作られる過程に起きる遺伝子発現や、リプログラミング現象を体外培養系で再構築することを目的にして実験を行いました。方法としては、生殖細胞を含めたほぼ全ての細胞になりうるES細胞やiPS細胞を材料として、それらを体外培養において始原生殖細胞に分化させることを試みました。材料としては、始原生殖細胞に特異的に発現する遺伝子であるBlimp1とStellaの発現制御下に、蛍光たんぱく質が発現するよう遺伝子改変したES細胞を用いました。これにより始原生殖細胞に分化した細胞は蛍光たんぱく質によって光を発するため、蛍光顕微鏡下で容易に観察できました。
これまでも、ES細胞から始原生殖細胞を分化させて体外で培養する技術開発は行われてきました。しかし、精子や健常な子孫を創出できる始原生殖細胞を体外培養で作製できた成功例はありませんでした。その原因として、適切なES細胞の分化培養条件を整えられなかったことが挙げられます。特に体内の発生では、始原生殖細胞はエピブラスト注5)と呼ばれる細胞集団から成長因子BMP4により誘導されます。これまでの研究では、ES細胞からエピブラストまでの分化培養条件の検討が不十分でした。本研究では、ES細胞を成長因子bFGFとActivinおよびKSR注6)で培養するという方法を開発し、世界で初めてエピブラストに近い状態の細胞を作製することに成功しました。本研究グループではこの細胞を、エピブラスト様細胞(Epiblast‐like cells:EpiLCs)と名付けました(図1)。
次に、このEpiLCsをBMP4により刺激した後、蛍光たんぱく質の発現を指標に始原生殖細胞様細胞(PGC(Primordial Germ Cell)-like cells:PGCLCs)を単離しました(図1)。単離されたPGCLCsの遺伝子発現パターンを調べると、体内の始原生殖細胞とほぼ同等であることが分かりました(図2)。またPGCLCsの誘導効率はBMP4刺激後2日目で約40%以上に達し、これまでの研究(3%以下)と比べて、飛躍的にその効率が向上しました。このPGCLCsを、生殖細胞を持たないc-kit変異マウスの精巣に移植した結果、PGCLCsは精子形成を開始し移植後約10週間後に精子にまで分化しました(図3)。これらの精子を卵細胞質内精子注入法(ICSI)注7)により卵子と授精させ、得られた受精卵を仮親の雌マウスに移植した結果、世界で初めて体外培養で分化させた始原生殖細胞に由来する健常なマウスが得られました(図3)。このマウスは正常に発達し、雌雄ともに生殖能力があると確認されました。
上記の研究に加え、始原生殖細胞に発現する表面抗原SSEA1とIntegrin-β3を認識する抗体を用いることにより、蛍光たんぱく質を持たないES細胞からもPGCLCsを単離することに成功しました。このPGCLCsからも健常なマウスが得られました。
さらに本研究では同様の培養条件により、iPS細胞でもPGCLCsの分化、精子の作製、健常マウスの取得に世界で初めて成功しました(図4)。
<今後の展開>
本成果は基礎および応用面の双方において大きな効果が期待できます。基礎面においては、生殖細胞形成メカニズムの解明やエピゲノムの詳細な解析が可能になることです。体内の始原生殖細胞は非常に少数であり、これまでそのエピゲノムの解析が困難でした。本研究による体外培養技術の開発によって、多数のPGCLCsを得ることが可能になり、始原生殖細胞が体細胞型から多能性幹細胞型にリプログラミングされる過程のエピゲノムを解析する上で十分かつ至適な細胞を供給できるようになりました。
また応用面においては、不妊症の原因究明や治療法の開発に効果が期待できます。この体外培養技術では、体内における始原生殖細胞の発生を、ES/iPS細胞を起点として忠実に再現できることから、この培養系を発生モデルとして用いて、始原生殖細胞の発生に必要な遺伝子の単離に貢献します。これらの遺伝子はヒトの不妊症の原因遺伝子となっている可能性があります。さらに、この体外培養技術を応用することにより、ヒトES細胞にから質の高い始原生殖細胞を分化誘導できる可能性が高まります。
<参考図>
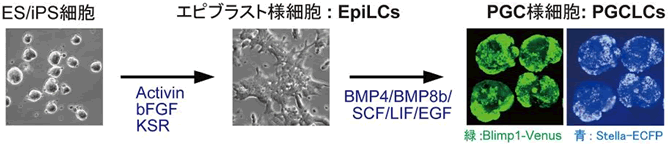
図1 ES/iPS細胞からのEpiLCsの分化とPGCLCsの誘導
ES/iPS細胞はActivin、bFGF、KSRと培養することによりEpiLCsに分化する。EpiLCsはさらにBMP4などの成長因子によりPGCLCsに分化する。PGCLCsに分化した細胞は蛍光たんぱくVenus(緑)およびCFP(青)を発現するため、容易に蛍光顕微鏡下で観察できる。
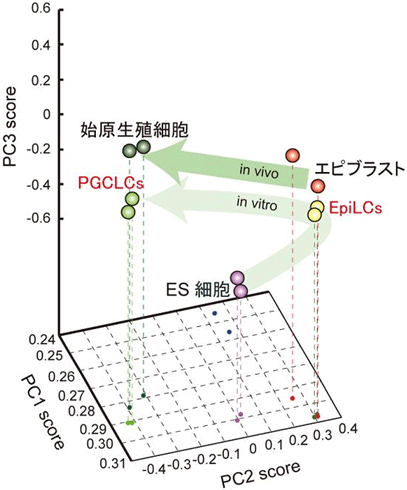
図2 EpiLCsからPGCLCsへの分化過程における遺伝子発現の推移
マイクロアレイ解析により、EpiLCsからPGCLCsへの分化過程で起こる遺伝子発現の変化を矢印(in vitro)で表した。その変化は体内でのエピブラストから始原生殖細胞への分化過程で起こる変化(矢印(in vivo))と同等である。
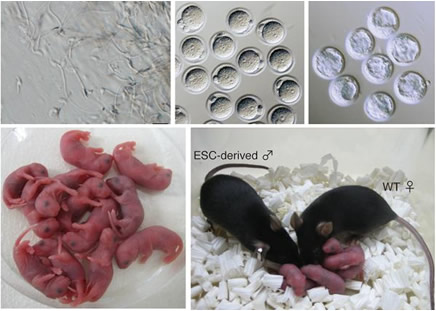
図3 PGCLCsの精巣への移植による精子作製とその精子を用いた産仔
PGCLCsを精巣に移植後10週間で精子の形成が認められた(上左)。得られた精子の顕微授精により受精卵が得られ(上中)、それらは胚盤胞まで発育した(上右)。これらの胚を仮親に移植した結果、産仔が得られ(下左)、それらのマウスは成体まで成長し、妊孕性が確認された(下右)。
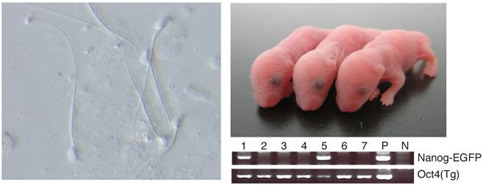
図4 iPS細胞からの精子作製とその精子を用いた産仔
iPS細胞(20D17)からPGCLCsを誘導し、それらを精巣に移植することにより精子を得た(左)。それらの精子を用いて顕微授精により受精卵を作製し、その移植により産仔を得た(右上)。これらの産仔のゲノムにはiPS細胞由来の外来遺伝子(Nanog-GFP)が検出された(右下)。
<用語解説>
- 注1) ES細胞
- 胚性幹細胞(Embryonic Stem cells)のこと。マウスの場合は受精後3~4日目の胚盤胞の内部細胞塊から、培養により得られる。体外培養により無限に増殖し、生殖細胞を含むほぼ全ての組織の細胞に分化することができる。
- 注2) iPS細胞
- 人工多能性幹細胞(induced Pluripotent Stem cells)のこと。皮膚などの体細胞に特定の因子を導入することにより作製される。ES細胞(注1参照)のように、無限に増殖し、生殖細胞を含むほぼ全ての組織に分化することができる。その一方で、最近の研究によりES細胞とは異なる体細胞型のエピゲノムが残存していることが指摘されている。
- 注3) 始原生殖細胞
- 全ての卵子もしくは精子の源となる細胞。発生の初期、マウスの場合は胚齢6.5日前後にエピブラスト(注5参照)から成長因子BMP4の働きにより分化する。発生初期は少数の細胞集団であり、その発生様式に性差はないが、胚齢12日目前後に体細胞の性によって、卵子もしくは精子へと分化することが決定される。
- 注4) エピゲノム
- ゲノムにおけるヒストンやDNAの化学的修飾は、後天的修飾(エピジェネティック修飾)と呼ばれ、発現遺伝子の選択やゲノムの安定性などに重要な働きを持つ。エピジェネティック修飾は、細胞種によりそのパターンが異なり機能的な差異を生み出している。エピゲノムとはゲノム全体に渡るエピジェネティック修飾の状態。
- 注5) エピブラスト
- マウスの場合、胚齢4.5~6.5日目に形成される多能性細胞集団。胚盤胞の内部細胞塊に由来する。生殖細胞を含むほぼ全ての体細胞の源になる細胞である。
- 注6) KSR
- 血清の代替品として培養液中に混合する試薬。血清成分を含まず、無血清培地を作製する時に用いる。
- 注7) 卵細胞質内精子注入法(ICSI:Intracytoplasmic Sperm Injection)
- 精子を顕微鏡下で微細ガラス管を用いて卵細胞質に直接導入して受精卵を得る方法。運動性の低い精子などの受精を助ける方法として、不妊治療にも用いられる。
<論文名>
“Reconstitution of the Mouse Germ-Cell Specification Pathway in Culture by Pluripotent Stem Cells”
(多能性幹細胞を用いた生殖細胞形成過程の試験管内再構成)
doi: 10.1016/j.cell.2011.06.052
<お問い合わせ先>
<研究に関すること>
斎藤 通紀(サイトウ ミチノリ)
京都大学 大学院医学研究科 生体構造医学講座 機能微細形態学 教授
〒606-8501 京都府京都市左京区吉田近衛町
Tel:075-753-4335 Fax:075-751-7286
E-mail:
<JSTの事業に関すること>
石井 哲也(イシイ テツヤ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: