慶應義塾大学 先端医科学研究所 遺伝子制御研究部門(責任者:佐谷 秀行 教授)の永野 修 助教、石本 崇胤 研究員らの研究グループは、慶應義塾大学 医学部 医化学教室(責任者:末松 誠 教授)、金沢大学がん研究所 腫瘍遺伝学研究分野の大島 正伸 教授、近畿大学薬学総合研究所の益子 高 研究員、熊本大学 大学院生命科学研究部 消化器外科学教室の馬場 秀夫 教授らとの多施設共同研究によって、癌幹細胞表面マーカーである接着分子CD44がシスチントランスポーターと結合することで癌細胞内の活性酸素(Reactive oxygen species;ROS)の蓄積を抑制し、腫瘍の増大と治療抵抗性を促進する分子機構について解明しました。今回の研究成果を基に、治療抵抗性を有する癌幹細胞をターゲットとした新たな治療法の開発が期待できます。なお本研究の一部は、JSTの事業の一環として行われました。
この研究成果は2011年3月14日(米国東部時間)、国際的な医学雑誌「Cancer Cell」2011年3月号オンライン版に掲載される予定です。
癌組織の中に存在し、その構成細胞を作る大本となる細胞を癌幹細胞と呼びます。抗癌剤・放射線治療に対する抵抗性や癌の再発・転移に癌幹細胞が深く関わることが広く知られるようになり、癌の根治を目指すためには、癌幹細胞を標的にした治療法の確立が重要な目標と考えられています。これまで、癌幹細胞を分離するためのマーカーの探索やそのマーカーで分離した細胞の特性解析が盛んに行われている一方で、それらマーカーが単に癌幹細胞を分別するための標識に過ぎないのか、それともそれ自身が機能的な役割を持つのかについては、ほぼ未解明のままでした。
今回の発表は、癌幹細胞の主要な表面マーカーの1つであるCD44を介した酸化ストレス注1)回避機構が、腫瘍の増大や治療抵抗性に関与することを明らかにしたものです。これらの知見は癌幹細胞を標的にした治療法の確立につながる大きな可能性を秘めていると考えられます。
1.研究の背景と目的
近年、癌組織中には自己複製機能を持ち、異なる分化段階の細胞を生産する能力を有する癌幹細胞の存在が知られており、癌における抗癌剤・放射線治療に対する抵抗性や癌の再発には、この癌幹細胞の存在が関与していると考えられています。そのため、癌幹細胞を認識する特異的なマーカーやその機能については、世界中で活発な研究が行われてきました。なかでもCD44陽性の癌細胞は、乳癌、膵臓癌、胃癌、大腸癌などの固形癌において、免疫不全マウスへの腫瘍形成能力が高く、癌幹細胞としての特性を持つことが報告されてきました。また、これまでに、癌幹細胞としての性質を維持するためには細胞内のROSが低く保たれていることが、重要であることが知られていました。そこで、永野助教らは、CD44が酸化ストレスへの抵抗性に関わるのではないかと考え、その分子メカニズムの解明に向けて本研究に取り組みました。
2.主要な研究成果ならびにその意義
まず、CD44高発現および低発現の消化器癌細胞株を用いてCD44の発現状態とROSの関連性を調べました。ROSの量を検出できる蛍光プローブを用いて細胞内のROSを定量化した結果、CD44高発現株においては細胞内ROSの蓄積が生じにくく、反対にCD44低発現株ではROSの蓄積が生じやすいことが分かりました。次に、このROS量の調節がCD44によるものかを検証するために、CD44高発現癌細胞においてCD44の発現をRNA干渉法(RNAi)注2)を用いて抑制してみると、細胞内ROSの蓄積が誘導できるようになることから、CD44がROSの蓄積を抑える何らかの機能を有していることが分かりました。そこで次に、その分子機構を解析した結果、非酵素性の抗酸化物質であるグルタチオンの細胞内含有量がCD44発現抑制により著明に低下し、細胞内ROSの蓄積を誘導することが分かりました。
さらに解析を進めた結果、CD44はグルタチオン合成の材料となる細胞外シスチン(アミノ酸の1つ)の取り込みに関わるトランスポーターxCT注3)を細胞膜上で安定化させることで、その抑制機能を高めることが分かりました。
細胞内ROSの蓄積は、酸化ストレスシグナルであるp38MAPKやp21の活性化を誘導し、癌の増殖および進展を抑制することが知られています。自然発症型胃癌マウスモデルを解析したところCD44が発現している癌細胞ではこれらの酸化ストレスシグナルの活性化が抑えられていることが分かりました(図1)。
そこで、次に、金沢大学がん研究所において開発された胃癌発症モデルマウスとCD44ノックアウトマウスを交配し、CD44ノックアウト胃癌マウスを作製して、生体レベルでのCD44の機能解析を行いました。その結果、CD44発現の抑制は腫瘍の増大に対して明らかな抑制効果を持つこと、またその際に酸化ストレスシグナルp38MAPK活性化およびp21の発現上昇が誘導されることが示されました(図2)。
これらの結果から、CD44を介した細胞内ROS抑制機構は、腫瘍の増大や治療に対する抵抗性に寄与していることが分かりました。つまりCD44の発現が高い癌においてはCD44やxCTを標的とした治療を行うことで、癌幹細胞を特異的に標的とした治療法を開発できる可能性を示しています(図3)。
3.今後の展開
既にxCTに対し特異的に阻害作用を示すことが知られている既存薬剤を用いた動物実験により、有意な腫瘍抑制効果および抗癌剤感受性増強効果が得られています。このことから、今後その薬剤を用いた臨床研究を臨床の先生方および企業と連携し行っていきたいと考えています。
4. 特記すべき事項
今回の研究成果は、我が国の5つの研究グループが、およそ6年の歳月をかけて互いの専門的知識と技能と資材を結集することによって完成したものであり、共同研究の相乗効果なしには到底為し得なかったと考えます。近年、領域を超えた多数のチームが、互いの力を融合させることによって成果を上げることが望まれていますが、その良い実例を示すことができたと思っています。
本研究の一部は、JST 戦略的創造研究推進事業 チーム型研究(CREST)の研究課題「人工癌幹細胞を用いた分化制御異常解析と癌創薬研究」(研究代表者:佐谷 秀行)、同事業 ERATO型研究「末松ガスバイオロジープロジェクト」(研究総括:末松 誠)の一環として行われました。また、現在、JST 研究成果最適展開支援事業(A-STEP)の課題として、癌治療用抗体医薬の実用化に向けた開発を進めています。
<参考図>
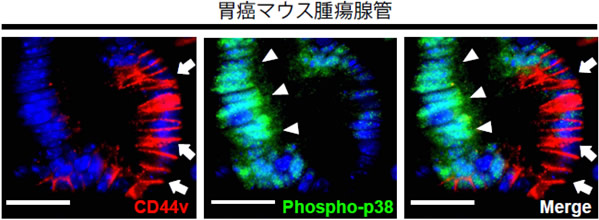
図1 胃癌マウスモデルにおけるCD44陽性癌細胞とp38MAPK活性化との関係
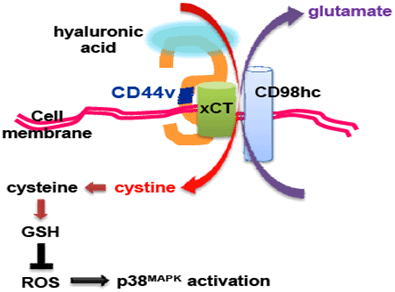
図2 CD44による酸化ストレスの抵抗性を促進するメカニズム
CD44vは、細胞膜表面においてシスチントランスポーターxCTを安定化させることで細胞外シスチンの取り込みを増加させ、抗酸化物質グルタチオン(GSH)の生成を促進する。その結果、腫瘍細胞は、酸化ストレスシグナルの活性化による腫瘍抑制シグナルから回避し、増殖時や治療時において発生するストレスに対して抵抗性を持つ。
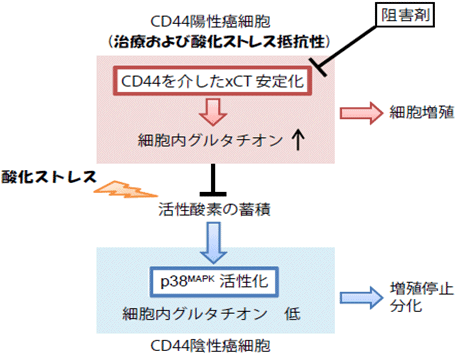
図3 CD44とxCTの相互作用を介した腫瘍細胞における酸化ストレス抵抗性のメカニズム
CD44やxCTを標的とした薬剤(阻害剤)は、癌幹細胞を含む治療抵抗性癌細胞に対して有効性を発揮すると考えられる。
<用語解説>
- 注1) 酸化ストレス
- 活性酸素の生成による酸化反応と、生体内の抗酸化システムによる抗酸化反応のバランスが崩れ、活性酸素が過剰となり生体にとって好ましくない状態のこと。
- 注2) RNA干渉法(RNAi)
- 標的とするタンパク質のmRNA発現を特異的に抑制する方法。
- 注3) xCT
- アミノ酸の1つであるシスチンを細胞内に取り込むために必要なトランスポーターを構成するタンパク質。
- 注4) CD44バリアントアイソフォーム(CD44v)
- 接着分子CD44では、mRNAが分断され、いくつかの部分が除去されて新しいmRNAができることにより、多種類の産物ができることが知られている。CD44vはそのうち癌組織で高発現するもの。
<お問い合わせ先>
<研究に関すること>
永野 修(ナガノ オサム)、佐谷 秀行(サヤ ヒデユキ)
慶應義塾大学 先端医科学研究所 遺伝子制御研究部門
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3982 Fax:03-5363-3982
E-mail:
ホームページ http://genereg.jp/index.html
<報道担当>
吉野(ヨシノ)
慶應義塾大学 医学部 庶務課
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3611 Fax:03-5363-3612
E-mail:
科学技術振興機構 広報ポータル部
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: