JST 課題解決型基礎研究の一環として、東京医科歯科大学 難治疾患研究所の樗木(オオテキ) 俊聡 教授らは、マウスの体内で腸管粘膜の防御に必須なIgA抗体注1)を作る新たなメカニズムを解明しました。
消化管などの粘膜面では、病原体の感染に対してIgA抗体が主体となって防御しています。一方、特に感染のない状態でも、恒常的に大量のIgAが作られています。このIgAは、無数に存在する常在菌から粘膜を守り、常在菌のバランスを維持することに役立っています。最近の研究により、恒常的なIgAの産生では、免疫反応の司令塔である樹状細胞注2)が重要な役割を担っていると考えられていますが、その詳細な仕組みはよく分かっていませんでした。
本研究グループは今回、この恒常的なIgA産生の仕組みを突き止めました。具体的には、腸内常在菌からの刺激が起点となり、Ⅰ型インターフェロン(IFN)注3)が産生されて、その刺激を受けた樹状細胞が「粘膜型」に変化します。「粘膜型」の樹状細胞では、IgAの産生を促すAPRIL(エイプリル)やBAFF(バフ)注4)というたんぱく質が多く発現しており、IgAの産生を効率よく誘導することを明らかにしました。一方で、APRILやBAFFの過剰な産生が自己免疫疾患やがんの誘導に関与しているとの報告もあることから、これらのたんぱく質やその産生細胞である樹状細胞を標的にすることで、新しいワクチンの開発や自己免疫病の治療に役立つものと期待されます。
本研究成果は、2011年2月17日(米国東部時間)に米国科学雑誌「Immunity」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立がんセンター 総長)
|
| 研究課題名 |
: |
「樹状細胞制御に基づく粘膜免疫疾患の克服」 |
| 研究代表者 |
: |
樗木 俊聡(東京医科歯科大学 難治疾患研究所 教授) |
| 研究期間 |
: |
平成20年10月~平成26年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、主に粘膜組織における樹状細胞群の免疫応答・免疫寛容誘導機構を明らかにすることで、粘膜免疫疾患を予防・治療する技術開発を目指します。
<研究の背景と経緯>
ウイルスや細菌などの病原体は、呼吸器や消化管などの粘膜を介して感染することが知られています。粘膜面では、病原体の感染に対してIgA抗体が主体となって、病原体である抗原と特異的に結合し、防御応答が誘導されます。IgAは、病原体が粘膜上皮細胞に付着・定着することを阻止したり、病原体から生産される毒素や酵素を中和することによって、感染からの防御に貢献しています。実用化が期待されている粘膜ワクチン注5)は、病原体に対するIgAをいかに効率よく粘膜面で産生できるかが実用化の鍵となっています。
一方、粘膜面では特に感染のない状態でも、恒常的に大量のIgAが産生されています。このIgAの役割は、無数に存在する常在菌から粘膜を守りながらそれら常在菌と共生する、さらには病原体に特異的なIgAが誘導されるまでの数日間を補完する上で重要であると考えられていますが、その産生の仕組みはよく分かっていませんでした。
IgAの産生経路は、T細胞注6)が必要なものと不必要なものの2種類に分けられます。特定の病原体に対して産生されるIgAはT細胞が必要な経路を介して産生されるのに対して、恒常的に産生されているIgAはT細胞を必要としない経路を介しても産生されます。後者は、今世紀になって発見された新しい経路で、樹状細胞が重要な役割を担っていると考えられています。腸管粘膜においては、B細胞注7)がパイエル板や腸間膜リンパ節などといった腸管粘膜リンパ組織注8)で分化した後、最終的に腸管粘膜固有層に移行してIgAを産生する形質細胞に分化することが分かっています。また、樹状細胞は腸管粘膜リンパ組織に局在していることも分かっていました(図1)。
しかし、どのようにして恒常的にIgAの産生が誘導されるのか、樹状細胞がどのような役割を果たしているかは不明でした。
<研究の内容>
樹状細胞は、従来型樹状細胞(cDC)と形質細胞様樹状細胞(pDC)に分類されます(図2A)。本研究グループは、cDCとpDCが恒常的なIgAの産生にどのような役割をしているのかを調べる目的で、たくさんのマウスの腸管粘膜リンパ組織からcDCやpDCを採取しました。分化することでIgAを産生するB細胞と、cDCやpDCを一緒に培養した結果、cDCに比べてpDCが強くIgAの産生を誘導することを突き止めました(図2B)。また、このIgA産生に必要なAPRILやBAFFがpDCで多く発現していることが分かりました(図2C)。さらに、pDCのIgAを産生する能力は、このAPRILやBAFFによるものであることも証明しました 。
それでは、全身で見られる通常のpDCは、APRILやBAFFが多く発現している「粘膜型」のpDCに、どのようにして変化するのでしょうか? 本研究グループは、APRILやBAFFの発現を誘導することが報告されているⅠ型IFNに着目しました。そこでⅠ型IFNの受容体を欠損するマウスの腸管粘膜リンパ組織からpDCを採取して、正常マウスの腸管粘膜リンパ組織から採取したpDCと比較しました。すると、Ⅰ型IFN受容体欠損マウスの腸管粘膜リンパ組織から採取したpDCでは、APRILやBAFFの発現が著しく減少していること(図3A)、また、IgAの産生を誘導する能力が著しく低下しており、さらにこの培養系にAPRILあるいはBAFFを補充することにより、IgAの産生が回復することも分かりました(図3B)。これらの結果は、正常なマウスの腸管粘膜リンパ組織においてⅠ型IFNが産生され、Ⅰ型IFNはpDCにAPRILやBAFFの産生を促して、pDCを「粘膜型」に変化させていることを示しています。
ここで、正常なマウスの腸管粘膜リンパ組織において、実際にⅠ型IFNを生産している細胞の特定を試みた結果、リンパ組織を取り囲む支持組織のストローマ細胞注9)ではⅠ型IFNが恒常的に発現していることが分かりました(図4)。また興味深いことに、腸内常在菌の存在しない無菌マウスの腸管粘膜リンパ組織から採取したストローマ細胞では、Ⅰ型IFNの発現が認められませんでした(図4)。これらの結果から、腸管粘膜リンパ組織において、ストローマ細胞からのⅠ型IFNの産生には腸内常在菌からの恒常的な刺激が必要不可欠であることも分かりました。さらに、ストローマ細胞から産生されるⅠ型IFNがpDCを刺激して、同細胞にAPRILやBAFFの発現が誘導され、その刺激でB細胞が分化した結果、IgAが恒常的に産生されているとも考えられました(図5)。
<今後の展開>
今回、腸内粘膜でIgAが恒常的に産生されるメカニズムが明らかになり、pDCがIgAの産生を促すAPRILやBAFFの産生細胞として、重要な役割を担うことが分かりました。
一方、Ⅰ型IFNやAPRILおよびBAFFの過剰生産は、全身性エリテマトーデス(SLE)やシェーグレン症候群をはじめとする自己免疫疾患や、ある種のがんの病態形成の一因になることも、ヒトやマウスで報告されています。本成果は、腸管免疫系における、APRILやBAFFおよびその産生細胞であるpDCを標的とした、新しいワクチン開発や自己免疫疾患の治療戦略に役立つものと期待されます。
<参考図>
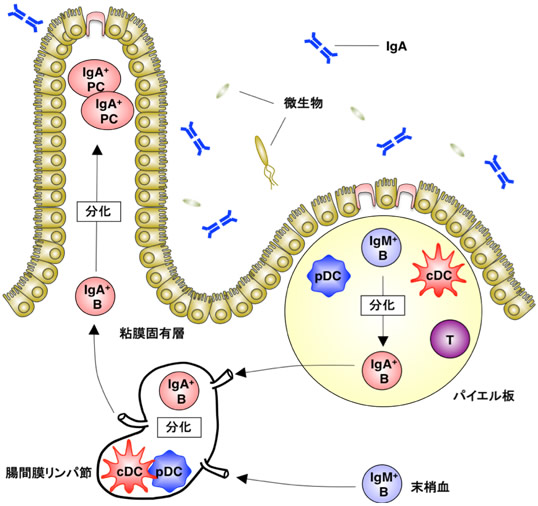
図1 腸管粘膜において恒常的に産生されるIgAの産生誘導機構と樹状細胞の局在
B細胞は腸管粘膜のパイエル板や腸間膜リンパ節などの腸管粘膜リンパ組織で、IgM+B細胞からIgA+B細胞に分化し、さらに腸管粘膜固有層に移行してIgAを産生する形質細胞(IgA+PC)に分化する。cDCとpDCは共にパイエル板や腸間膜リンパ節に局在しており、恒常的に産生されるIgAの産生に重要な役割を担っていると考えられていた。
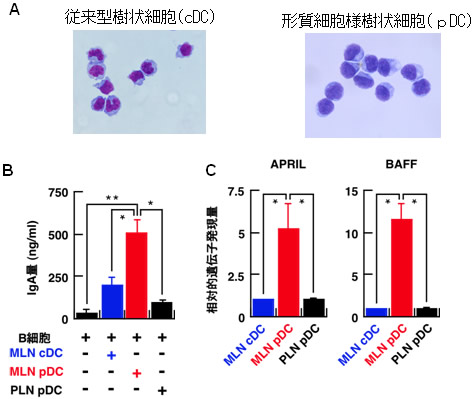
図2 IgA産生誘導におけるpDCの優れた能力
(MLN:腸間膜リンパ節 PLN:末梢リンパ節)
- (A) 樹状細胞(DC)の形態(顕微鏡写真):cDCは細胞表面に多数の突起を持ち、細胞核(濃い紫色の部分)の形状が一様でないのに対して、pDCには細胞表面に突起がなく、細胞核は卵形であるという特徴がある。
- (B) 各種DCとB細胞を培養した後のIgA産生量:腸間膜リンパ節のpDC(MLN pDC)はIgAの産生誘導量が大きいことが分かる。
- (C) 各種DCにおけるAPRILやBAFFのmRNA発現量:MLN pDCではAPRILやBAFFが多く発現していることが分かる。
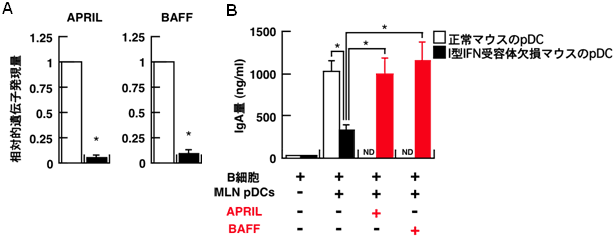
図3 Ⅰ型IFNがpDCにAPRIL/BAFFの発現を誘導する
- (A) 正常マウスではⅠ型IFN受容体欠損マウスに比べて、腸間膜リンパ節から採取したpDC(MLN pDC)におけるAPRILやBAFFの発現量が多い。
- (B) 正常マウスあるいはⅠ型IFN受容体欠損マウスのMLN pDCを、正常マウスのB細胞と培養した後のIgA産生量を示す。Ⅰ型IFN受容体欠損マウスのMLN pDCではIgAの産生量が少ないことが分かる。また、Ⅰ型IFN受容体欠損マウスのMLN pDCにAPRILおよびBAFFを添加すると、IgAの産生が促進されることが分かる。
※N.D(未実験): 正常マウスのMLN pDCにAPRILおよびBAFFを添加する実験は行っていない。
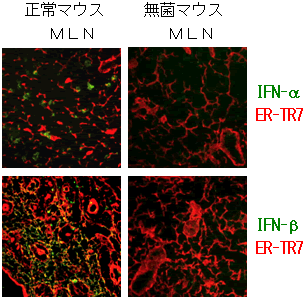
図4 Ⅰ型IFNを産生するストローマ細胞の同定
腸間膜リンパ節(MLN)の凍結組織切片を、Ⅰ型IFN(IFN-αあるいはIFN-β)とストローマ細胞(ER-TR7)に対する蛍光標識抗体で染色した蛍光顕微鏡写真を示す。正常マウスのMLNではストローマ細胞にⅠ型IFNが存在しているのに対し、無菌マウスのMLNにはⅠ型IFNが存在しない。
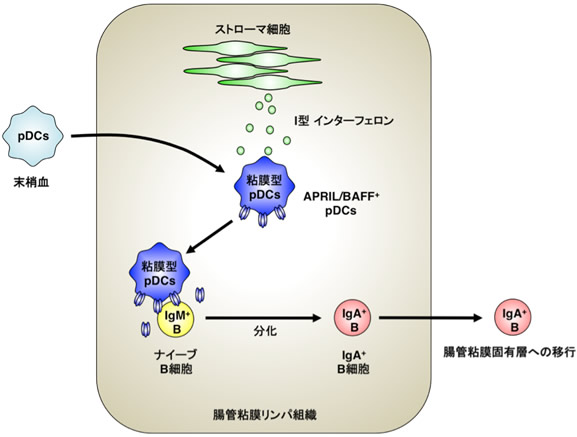
図5 Ⅰ型IFNによるpDCへのIgA産生誘導能力の付与の機構
腸内粘膜では腸内常在菌による刺激を受け、腸管粘膜のストローマ細胞からⅠ型IFNが産生される。末梢から腸管粘膜リンパ組織に移行した「通常」のpDCは、Ⅰ型IFNの刺激によってAPRILやBAFFが発現した「粘膜型」のpDCになる。この「粘膜型」pDCは、APRILやBAFFを介して、B細胞をIgM+B細胞からIgA+B細胞に分化させる。このIgA+B細胞は、さらに腸管粘膜固有層に移行してIgAを産生する形質細胞(IgA+PC)に分化する。
<用語解説>
- 注1) IgA抗体
- 抗体の一種で、消化管や呼吸器などの粘膜における免疫反応の主体である。
- 注2) 樹状細胞
- 全身のリンパ組織に分布している血球細胞の1つで、代表的な抗原提示細胞として、抗原を取り込んで、他の免疫細胞に伝える働きを持つ。形態学的特徴や免疫学的機能からcDCとpDCに分類される。cDCがT細胞に対する強力な抗原提示能力を有しているのに対し、pDCはウイルスや細菌の感染時にⅠ型インターフェロンを産生し、抗原提示能力は低いことが知られている。
- 注3) Ⅰ型インターフェロン(IFN)
- ウイルス感染に対して免疫系を調整する働きを持つインターフェロンの総称である。Ⅰ型IFNの働きを強めるⅡ型IFNなどと区別するために「Ⅰ型」の呼称があるが、通常インターフェロンというとⅠ型IFNのことを指す。
- 注4) APRIL(A proliferation inducing ligand)、BAFF(B cell activating factor belonging to the TNF family)
- B細胞活性化因子として同定されたサイトカインである。樹状細胞をはじめとする抗原提示細胞以外にも、粘膜上皮細胞などから産生されることが知られている。また、粘膜組織ではIgA産生に重要な働きを持つ一方で、過剰量のAPRIL/BAFFは自己免疫疾患やがんの原因となることが知られている。最近、Ⅰ型IFNの刺激によってAPRILやBAFFの産生が誘導されることが報告されている。
- 注5) 粘膜ワクチン
- 経口や経鼻投与などによって、全身性の免疫のみならず、粘膜面での感染を防御する免疫機構を誘導することができるので、特に粘膜を介して感染するウイルスに対して有効であるとして期待されている。一方で粘膜ワクチンは抗原を単独で投与しても十分な免疫を誘導することができず、免疫増強剤との併用投与が必要不可欠であることが明らかとなっているが、免疫増強剤は重篤な副作用があり未だ実用化に至っていない。
- 注6) T細胞
- 胸腺由来のリンパ球で、末梢血中のリンパ球の70~80%を占める。他の免疫細胞の機能発現を誘導する働きなどがあるヘルパーT細胞や、ウイルス感染細胞などを破壊するキラーT細胞などがある。
- 注7) B細胞
- 骨髄で分化成熟したリンパ球で、細胞表面に抗原レセプターとして免疫グロブリン(Ig)を発現している。抗原提示細胞により自分に適合した抗原が提示されると、形質細胞に分化して、免疫グロブリンを抗体として産生するようになる。
- 注8) 腸管粘膜リンパ組織
- 腸管粘膜リンパ組織は消化管粘膜やその周囲に散在するリンパ組織で、小腸に散在するパイエル板や生体内で最大のリンパ組織である腸間膜リンパ節などが含まれる。腸管粘膜防御に重要なIgA抗体を産生する場として知られている。
- 注9) ストローマ細胞
- 臓器は、それぞれの臓器に固有の働きを受け持つ実質と、それを支えるストローマ(間質)から構成されている。実質は実質細胞から構成され、ストローマはストローマ細胞(間質細胞)と非細胞性の成分であるマトリックス(細胞外基質)により構成される。ストローマ細胞はさまざまな種類のサイトカインを産生し、各臓器における実質細胞の分化や免疫反応に重要な役割を果たしている。
<論文名>
“Prominent role for plasmacytoid dendritic cells in mucosal T cell-independent IgA induction”
(形質細胞様樹状細胞はT細胞に依存しない優れたIgA産生誘導能力を備えている)
doi: 10.1016/j.immuni.2011.02.002
<お問い合わせ先>
<研究に関すること>
樗木 俊聡(オオテキ トシアキ)
東京医科歯科大学 難治疾患研究所 先端分子医学研究部門 生体防御学分野 教授
〒101-0062 東京都千代田区神田駿河台2-3-10
Tel:03-5280-8054 Fax:03-5280-8055
E-mail:
<JSTの事業に関すること>
河村 昌哉(カワムラ マサヤ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3531 Fax:03-3222-2066
E-mail: