JST 課題解決型基礎研究の一環として、名古屋大学 大学院理学研究科の近藤 孝男 教授と秋山 修志 講師らは、藍藻の時計たんぱく質注1)が、あたかも心臓が拍動するかのように形状をリズミカルに膨張・収縮させ、24時間周期で時を刻むことを明らかにしました。
藍藻(シアノバクテリア)は生物時計を備えた最も下等な生物で、その時計は3種類の時計たんぱく質(KaiA、KaiB、KaiC)からなります。本研究グループは、これまでの研究から、この3つの時計たんぱく質をATP注2)存在下で混合すると、KaiCのATP加水分解酵素(ATPase)活性やリン酸化状態が24時間周期で振動することを示してきました。このことは、KaiCのATPase活性が生物時計の周期を規定する重要な因子であると考えられ、ATPase活性の増減に伴ってKaiCの分子形態がどのように変動するのか、その分子機構の解明が期待されていました。
研究グループは今回、大型放射光施設 SPring-8注3)の理研構造生物学ビームラインI(BL45XU:X線小角散乱法注4))や蛍光分光法を用いて、溶液中のKaiC分子が24時間周期で形状をリズミカルに変化させることを解明しました。KaiCは、ドーナツを2つ積み上げたような二重のリング状構造をしていますが、片方のリングにあるATPaseの制御状態と密に連動して、もう片方のリング半径が大きく膨らんだり、縮んだりを繰り返します。KaiAやKaiBはこの膨張・収縮を感知することで、KaiCと結合・解離するタイミングを計っています。ATPaseの基準信号をKaiCの構造変化へと変換し、さらにそれを通じてKaiAやKaiBの結合・解離と連動させることで、より頑強で安定な24時間振動を実現しているものと考えられます。
本研究によってKaiCの構造変化の一端が解明され、KaiCがATPase活性の自己制御を通じてどのように24時間周期を実現しているのかを解明するための分子基盤が整備されました。シアノバクテリアで解明されつつあるATPを使った分子時計のフレームワークは今後、人間を含めた高等生物の時計研究の手がかりになるものと期待されます。
本研究成果は、2010年11月26日(英国時間)に欧州科学雑誌「The EMBO Journal」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「生命システムの動作原理と基盤技術」
(研究総括:中西 重忠 (財)大阪バイオサイエンス研究所 所長)
|
| 研究課題名 |
: |
「シアノバクテリアの概日システム」 |
| 研究代表者 |
: |
近藤 孝男(名古屋大学 大学院理学研究科 教授) |
| 研究期間 |
: |
平成19年10月~平成25年3月 |
JSTはこの領域で、生命システムの動作原理の解明を目指して、新しい視点に立った解析基盤技術を創出し、生体の多様な機能分子の相互作用と作用機序を統合的に解析して、動的な生体情報の発現における基本原理の理解を目標としています。上記研究課題では、シアノバクテリアの概日システムに関する研究を通じて、細胞内における機能分子の動的自己制御機構の解明を目指しています。
<研究の背景と経緯>
多くの生物に見られる生物時計は、代謝や光合成といった重要な生命活動を昼夜環境サイクルに同調させるための基礎的な制御機構です。時計機能を支える時計たんぱく質や遺伝子が損傷を受けると、細胞内の広範な生理活性調節にまで障害が及び、重篤な病気の引き金となることが指摘されています。生物時計の動作原理について理解を深めることは、私たち人間を含めた生物の生活の質を維持向上させることにつながります。
シアノバクテリアは生物時計を備えた最も下等な生物で、その時計は3種類の時計たんぱく質(KaiA、KaiB、KaiC)からなります。3つの時計たんぱく質とATPを試験管内で混合すると、KaiCのATPase活性やリン酸化状態が24時間周期で振動します。これまでの研究から、KaiCのATPase活性が生物時計の周期を規定する重要な因子であることが強く示唆されていました。KaiCがペースメーカーの役割を担うなら、他の時計たんぱく質に時刻情報を伝えるため、KaiCは自ら状態や構造を変化させると予測されます。しかし、すでに解明されていたKaiCのX線結晶構造からは、その変化を捉えることができませんでした。本研究グループはその理由を、時を刻むKaiCの構造は柔軟であるため、結晶という形態に整列させると分子の本来あるべき姿が損なわれるからではないかと考えました。
<研究の内容>
本研究グループの秋山講師らは今回、これまでにJST 個人型研究(さきがけ)「生命現象と計測分析」(研究総括:森島 績)研究領域における研究課題「時間と共に離合集散を繰り返す分子機械のX線小角散乱・動的構造解析」で培ったX線小角散乱による動的構造解析法を駆使し、ATPase活性に連動したKaiCの形状変化を結晶ではなく溶液中で詳しく検証しました。
KaiCを溶液に入れ、その状態を実時間で追跡したところ、ATPase活性、リン酸化状態、分子形状を互いに連動させつつ、KaiCが4つの状態を経由することが明らかになりました(図1)。KaiCの二重リング状構造のうち、C1リングのATPase活性と密に連動して、C2リングが大きく膨張・収縮を繰り返します。この状態変化はKaiC単独で調べたものですが、実際にKaiAやKaiBが共存する振動反応においても、KaiCが同様の構造転移を起こすことが蛍光分光法で確認されています(図2)。
これらはKaiCの構造変化を捉えた世界初の観察であり、KaiCがペースメーカーの役割を担っていることを強く支持します。C2リングの膨張は、KaiAやKaiBをKaiCに引きつけるタイミング信号の役割も兼ねており、安定なKaiA:KaiB:KaiC複合体の形成を促します(図3)。ATPase活性から来る基準信号をC2リングの形状変化へと変換し、さらにそれを通じてKaiAやKaiBの結合・解離と連動させることで、より頑強で安定な24時間発振を実現しているものと考えられます。
<今後の展開>
今回の成果は、Kaiたんぱく質時計の中核をなす振動子が「チクタク…」と時を刻む様子を捉えたものであり、時計機能を発現するための基本要素がKaiCに内包されていることを強く支持するものです。今後、ATPase活性とKaiCの鼓動をリンクする仕組みについて分解能を空間と時間の両次元に高めつつ検証することで、「24時間を規定する構造生物学的からくり」に迫ることができると期待されます。今のところ、KaiCのような機能を有するたんぱく質が見いだされているのはシアノバクテリアのみですが、ATPを使ったタイミング制御は人間を含めた高等生物でも姿形を変えて存在している可能性があり、今後の生物時計研究の手がかりになるものと期待されます。
<参考図>
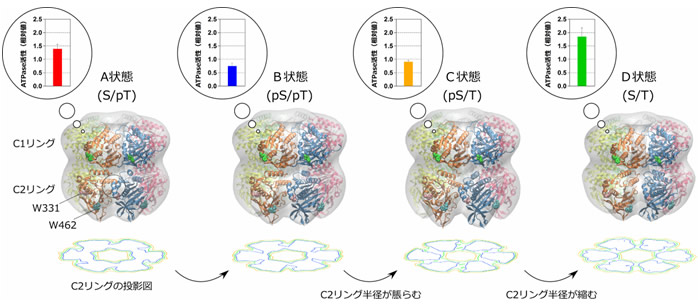
図1 KaiCのATPase活性と共役したC2リングの膨張・収縮運動
灰色部分はX線小角散乱により解明されたKaiCの分子形状を表す。リボンモデルはX線小角散乱の実験データに合致するよう、既知のX線結晶構造を使って構築した高分解能分子モデル。W331およびW462は、C2リングのトリプトファン残基の位置を示している。各モデルの直下には、C2リングのみを投影した等高線図が示されている。AからB状態への変化ではC2リングの大きさはあまり変化しない。しかしBからC状態へ遷移する際、C2リング半径が大きく膨らむことが、等高線図の谷が深くなっている点からも読み取れる。
C2リングの膨張収縮運動はC1リングのATPase活性の増減と共役している。
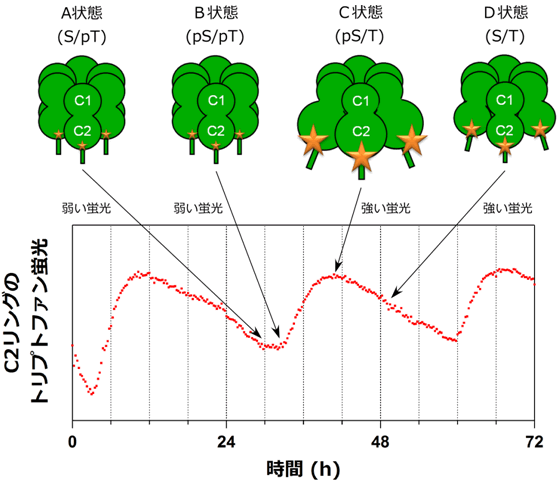
図2 KaiCはC2リングを膨張・収縮させつつ時を刻む
KaiAやKaiBが存在する条件下で、KaiCのC2リングにあるトリプトファン残基(図1:W331およびW462)の蛍光強度の変化を計測した。図中のKaiCに記されている星印の大小は、トリプトファン残基からの蛍光強度の大小を模式的に表現している。
図1に示されるようなC2リングの膨張収縮具合に応じ、W331やW462の強度も24時間の周期で増減を繰り返す。
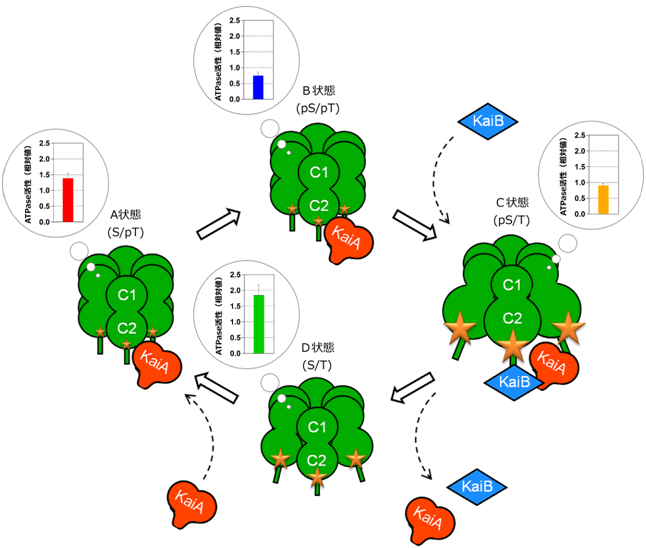
図3 Kaiたんぱく質時計の反応サイクルの模式図
C1リングにあるATPaseの制御状態は、C2リングの膨張収縮状態と共役しており、その分子鼓動を指針にKaiAやKaiBは離合集散のタイミングを計っている。結合したKaiAやKaiBはATPase活性に変調を与え、反応サイクルをより力強く安定に保っている。
<用語解説>
- 注1) 時計たんぱく質
- 生物が時計機能を維持するために必須となるたんぱく質の総称である。時計たんぱく質の変異や欠損により、生物のさまざまな行動において、リズム特性が変調を受ける。
- 注2) ATP
- アデノシン三リン酸(Adenosine Triphoshate)のことで、筋肉が収縮するときなどにエネルギー源として利用される物質。生物体で用いられるエネルギー保存および利用に用いられるヌクレオチドであり、その生物体内の存在量や物質代謝における重要性から「生体のエネルギー通貨」と呼ばれる。アデノシンという物質に3つのリン酸基が結合した形をしているが、ATP加水分解酵素の働きによって、リン酸基がはずされて分解される。1つのリン酸基がはずれる毎に、約8kcal/molのエネルギーを放出する。
- 注3) 大型放射光施設 SPring-8
- 兵庫県の播磨科学公園都市にある世界最高輝度の放射光を生み出す、理化学研究所の共同利用施設。その名前は、Super Photon ring-8GeVに由来する。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細く強力な電磁波のこと。SPring-8では、この放射光を用いて、物理、化学、地学などの基礎研究から、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。
- SPring-8ホームページ http://www.spring8.or.jp/ja/
- 注4) X線小角散乱法
- X線を物質に照射して散乱するX線のうち、散乱角が小さいものを測定することにより物質の構造情報を得る手法で、たんぱく質や核酸などの生体高分子、微粒子や液晶、合金の内部構造といった数ナノメートルレベルでの構造解析に用いられる。
<論文名>
“Tracking and Visualizing the Circadian Ticking of the Cyanobacterial Clock Protein KaiC in Solution”
(シアノバクテリア時計たんぱく質KaiCの分子鼓動を可視化)
<お問い合わせ先>
<研究に関すること>
秋山 修志(アキヤマ シュウジ)
名古屋大学 大学院理学研究科 生命理学専攻 講師
〒464-8602 愛知県名古屋市千種区不老町
Tel:052-789-2507 Fax:052-789-2495
E-mail:
近藤 孝男(コンドウ タカオ)
名古屋大学 大学院理学研究科 生命理学専攻 教授
〒464-8602 愛知県名古屋市千種区不老町
Tel:052-789-2498 Fax:052-789-2495
E-mail:
<JSTの事業に関すること>
長田 直樹(ナガタ ナオキ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<SPring-8の理研ビームラインに関すること>
山本 雅貴(ヤマモト マサキ)
理化学研究所 放射光科学総合研究センター 基盤研究部 部長
Tel:0791-58-2839 Fax:0791-58-2834
E-mail:
<報道担当>
科学技術振興機構 広報ポータル部
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
名古屋大学 広報室
〒464-8601 愛知県名古屋市千種区不老町
Tel:052-789-2016 Fax:052-788-6272
E-mail:
理化学研究所 広報室 報道担当
〒351-0198 埼玉県和光市広沢2-1
Tel:048-467-9272 Fax:048-462-4715
E-mail: