JST 課題解決型基礎研究の一環として、東京医科歯科大学 難治疾患研究所の岡澤 均 教授らは、ポリグルタミン病注1)における認知障害の基礎となるメカニズムを明らかにしました。
ハンチントン病などポリグルタミン病の一部には認知障害が起きることが知られていますが、その詳細な分子メカニズムについて明らかになっていませんでした。岡澤教授らは先に、複数のポリグルタミン病原因たんぱく質と結合する新規分子PQBP1注2)を発見しました。PQBP1は、DNAからRNAへの転写やRNAスプライシング注3)などの細胞核機能に関わることが知られています。ハンチントン病や脊髄小脳変性症1型などの原因たんぱく質がPQBP1と結合してその正常機能を阻害することが、発症につながる病態の1つと考えられます。さらに、PQBP1遺伝子に異常があると精神発達遅滞の原因となることが報告されており、学習や記憶におけるPQBP1の役割に注目が集まっています。
本研究グループは今回、PQBP1の遺伝子発現が低下したPQBP1変異ショウジョウバエを作成し、学習および記憶におけるPQBP1の分子機能を検討しました。その結果、PQBP1変異体ではシナプス分子であるNMDA受容体の構成分子NR1の発現が低下し、このために学習ができなくなっていることを明らかにしました。さらに、転写量を増やすある種の薬剤が、学習障害の症状改善につながることも示しました。この成果は今後、ポリグルタミン病の認知障害の治療開発につながるものと期待されます。
本研究は、東京医科歯科大学の田村 拓也 助教と共同で行われ、本研究成果は、2010年10月20日(米国東部時間)に米国科学雑誌「The Journal of Neuroscience」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「精神・神経疾患の分子病態理解に基づく診断・治療へ向けた新技術の創出」
(研究総括:樋口 輝彦 国立精神・神経医療研究センター 理事長) |
| 研究課題名 |
: |
「ポリグルタミン病の包括的治療法の開発」 |
| 研究代表者 |
: |
貫名 信行(理化学研究所 脳科学総合研究センター チームリーダー) |
| 共同研究者 |
: |
岡澤 均(東京医科歯科大学 難治疾患研究所 教授) |
| 研究期間 |
: |
平成21年10月~平成27年3月 |
JSTはこの領域で、少子化・高齢化・ストレス社会を迎えた日本において社会的要請の強い認知・情動などをはじめとする高次脳機能の障害による精神・神経疾患に対して、脳科学の基礎的な知見を活用し、予防・診断・治療法などで新技術の創出を目標にしています。
上記研究課題では、本質的な治療法のない遺伝性神経変性疾患のポリグルタミン病について、異常たんぱく質凝集の抑制・分解過程の制御、転写異常などの病態過程の制御の観点からの治療法の開発を目指します。
<研究の背景と経緯>
ハンチントン病や脊髄小脳失調症を含む「ポリグルタミン病」は、アルツハイマー病やパーキンソン病に次いで患者数の多い神経変性疾患グループですが、有効な治療法は確立されておらず、その病態解明と治療開発は重要な社会的問題です。
ポリグルタミン病は、遺伝子内でグルタミンというアミノ酸をコードする3つの塩基配列(C=シトシン、A=アデニン、G=グアニン)の繰り返し数が増加したために起こる神経変性疾患であり、複数の遺伝性脊髄小脳失調症(SCA2、SCA3、SCA6、SCA7、SCA17)、ハンチントン病、球脊髄性筋萎縮症が、このグループに属することが知られています。いずれも、ポリグルタミン鎖が伸長した異常たんぱくが脳に蓄積することから、共通の病態を持つと考えられています。
ハンチントン病やSCA17においては大脳萎縮や認知障害が見られますが、具体的にどのような分子メカニズムを介して認知症に至るのかは明らかになっていませんでした。
<研究の内容>
東京医科歯科大学の岡澤教授らは1999年に、ヒトのポリグルタミン病病態関連分子としてPQBP1を発見しました。その後、PQBP1がハンチントン病やSCA1の原因たんぱく質と結合すること、そしてPQBP1が基本転写因子やRNAスプライシング因子と結合することを明らかにしてきました。この間に、ヨーロッパの大規模な共同研究から、PQBP1は遺伝性精神発達遅滞の原因遺伝子である注4)ことが明らかになっています。PQBP1はヒトから線虫や植物に至るまで非常に良く保存された分子で生物にとって重要な機能を持つことが推測されます。
ポリグルタミン病の原因たんぱく質はPQBP1と結合して転写機能を障害し、一方、精神発達遅滞患者においては遺伝子変異のためにPQBP1の量が低下していることが知られています。ポリグルタミン病も精神発達遅滞も、学習や記憶に問題を生じることから、PQBP1機能低下が2つの病態に共通する役割を果たしていることが想定されていましたが、その分子メカニズムについては未解決でした。
本研究グループは今回、トランスポゾン注5)の挿入変異によってPQBP1の発現量が減少したショウジョウバエを作成して、学習と記憶を詳細に解析するとともに、PQBP1変異ショウジョウバエの記憶に関わる神経回路の形態変化と機能変化を詳細に検討しました。
その結果、以下のことが明らかになりました。
- 1)PQBP1発現減少(すなわち機能低下)は学習獲得の障害につながるが、さまざまな記憶の成分(短期記憶、麻酔耐性記憶、長期記憶)には大きな影響を与えないこと(図1)。
- 2) PQBP1減少は、ニューロンの数の減少や細胞死には結びつかないこと(図2)。
- 3) PQBP1減少は、NMDA受容体の構成成分であるNR1の減少につながり、このためにシナプスレベルでの学習効果が低下すること(図3)。
- 4) 投射ニューロンのみでPQBP1の発現抑制を行うと、認知障害が出ること(図4)。
さらに、これまではショウジョウバエにおいてキノコ体という脳構造が学習・記憶を担っていると考えられてきましたが、今回の研究から投射ニューロンのPQBP1に依存した可塑性が、においの学習・記憶にとって重要であることが示されました。つまり、PQBP1は投射ニューロンによる学習を担うことが証明された初めての分子と言えます。
また、PQBP1変異体における学習能力の低下は、変異体の発生段階の異常によるものではなく、ショウジョウバエが成虫(大人)になってから生じる機能変化が原因であること(図5)、さらに、転写量を上昇させるHDAC阻害剤注6)によって症状が可逆的に改善することも明らかになりました(図6)。
なお、本研究の一部(ショウジョウバエの発達障害やシナプス分子の機能異常の解析)は、文部科学省 科学研究費補助金 新学術領域研究『シナプス・ニューロサーキットパソロジーの創成』の支援を受けて行われました。
<今後の展開>
今回の研究成果で、ポリグルタミン病やPQBP1遺伝子変異における認知障害のメカニズムの一端が明らかになりました。岡澤教授らはすでに同様にPQBP1の発現が低下することにより認知障害を示したノックダウンマウスを作成し、脳におけるNR1の発現低下と、HDAC阻害剤による症状の改善を報告しています(Ito et al. Hum Mol Genet 2009)。本研究において遺伝学的アプローチを精密に行いうるショウジョウバエ実験系を用いて、認知障害を介在する分子であるPQBP1やNR1の作用機序と、HDAC阻害剤の治療効果を確認することができたことから、NR1などの遺伝子発現を回復させることを通じて認知障害にアプローチする新しい治療戦略が示され、今後の治療法の開発への展開が期待されます。
<参考図>
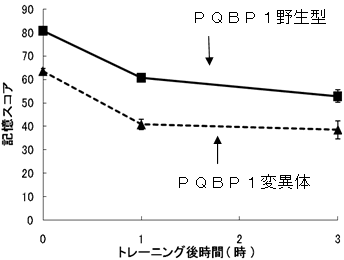
図1 PQBP1変異ショウジョウバエでは学習獲得が低下している
ショウジョウバエの学習については、1985年にTullyらによって開発されたティーチングマシンによるにおい条件付けによるテストを行った。100匹のハエをトレーニング容器に入れ、最初に、あるにおいをかがせながら、電気ショックを与える。次に別のにおいを、電気ショックなしで、かがせる。その後、所定の時間経過後に、2つのにおいを同時にかがせるテストを行う。記憶が残っていればハエは第2のにおいの方に集まるはずだが、この割合で記憶スコアを評価する、という方法である。
PQBP1変異体では、トレーニング直後(0時間)すでに野生型より記憶スコアが低い。しかし、その後時間が経過しても両者の差は広がらず、記憶のカーブは平行であった。このことは、PQBP1変異体では学習の獲得自体が阻害され、記憶の保持は正常であることを示している。
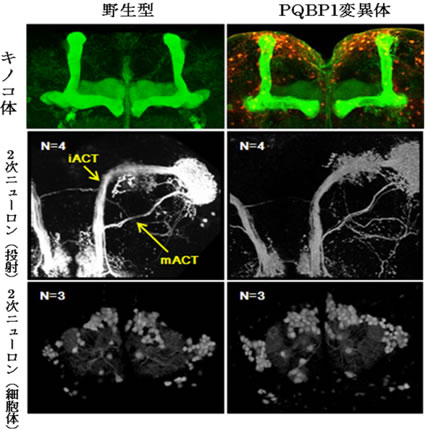
図2 PQBP1変異体のニューロンは正常である
野生型(左)とPQBP1変異体(右)において、キノコ体の形態(上図、緑色)におい二次ニューロンの投射(中図)と細胞体の数(下図)には差がなかった。キノコ体とにおい二次ニューロンは学習記憶に重要であることが知られている。
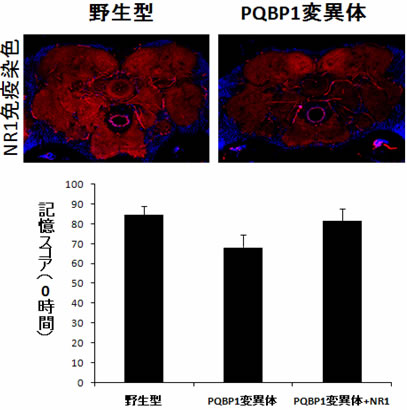
図3 PQBP1減少はNR1発現低下を介して学習を制御する
野生型およびPQBP1変異体の脳の染色を示す。PQBP1変異体ではNR1(上図中の赤色)の発現が局所的に低下している。また、PQBP1変異体にNR1を強制発現させると学習は正常に回復した(下グラフの右バー)。
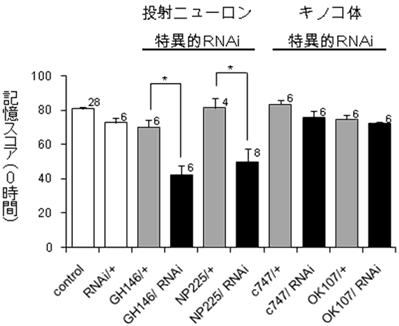
図4 投射ニューロンでPQBP1を発現抑制すると学習が阻害される
投射ニューロンでPQBP1遺伝子発現を抑制すると(黒バー)、対照実験(灰色バー)と比較して学習が阻害された。これに対して、キノコ体でPQBP1遺伝子の発現を抑制した場合は学習を阻害しなかった。
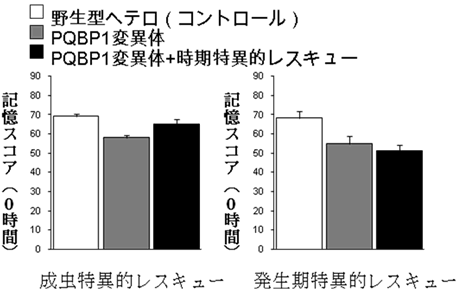
図5 PQBP1とNR1は、成虫の学習に必要である
PQBP1変異体の成虫にNR1を強制発現させると、学習低下を改善したが(左図)、成虫になる前に同じ実験をしても、PQBP1変異体の学習低下は改善されなかった(右図)。
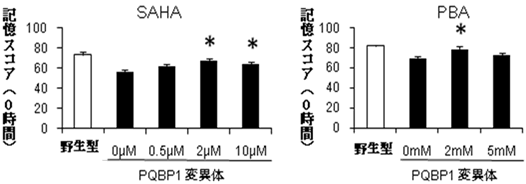
図6 HDAC阻害剤はPQBP1変異体の学習低下を改善する
2種類のHDAC阻害剤、SAHA(suberolyanilide hydroxamic acid、左図)とPBA(phenyl butyrate、右図)はどちらも、ある濃度でPQBP1変異体の学習低下を回復した。SAHAは2μMと10μMで、PBAは2mMで回復が見られた。濃度の高すぎるSAHAやPBAには毒性があった。
<用語解説>
- 注1) ポリグルタミン病
- それぞれ異なる原因遺伝子を持つ遺伝性の神経変性疾患の一群であり、現在9種類の疾患が知られている。原因遺伝子のエキソン内部にあるCAG繰り返し配列が異常伸長することにより、グルタミンが多数つながった構造であるポリグルタミン鎖が異常伸長した原因たんぱく質が発現するグループである。異常伸長したポリグルタミン鎖はβシートと呼ばれる立体構造を取りやすく、これが基盤となってたんぱく質の凝集を起こしやすくなると言われている。CAG繰り返し配列が長いほど症状が早く進行し、また重篤になることが明らかとなっている。
- 注2) PQBP1
- PQBP1は、変異型伸長ポリグルタミン配列と結合するたんぱく質として発見された(Waragai et al. Hum Mol Genet 1999)。たんぱく質相互作用領域を介してRNAスプライシング因子や遺伝子の転写に必要なRNAポリメラーゼIIなどと結合することが分かっている。このため、PQBP1の機能は遺伝子発現の調節にあるのではないかと考えられている。
- 注3) RNAスプライシング
- 遺伝子発現の過程はDNAからRNAを作る「転写」と、RNAからたんぱく質を作る「翻訳」に分かれる。遺伝子にはたんぱく質の情報をコードする「エキソン」と情報をコードしていない「イントロン」と呼ばれる領域が存在する。遺伝子発現の過程においてRNAからイントロンを除去するステップがあり、これをRNAスプライシングと呼ぶ。
- 注4) PQBP1は遺伝性精神発達遅滞の原因遺伝子である
- 2003年にドイツのカルショウアー博士らが行った研究によると、X連鎖性精神遅滞症候群(発症の原因となる遺伝子がX染色体にある精神遅滞)の29家系の内、5家系がPQBP1遺伝子変異によるものだった。これはX連鎖性精神遅滞の中でも頻度の高いレット症候群に近く、脆弱X症候群(X染色体上のFMR1遺伝子の機能不全が原因とされる精神発達障害)に次ぐ頻度であった。また、痩せ型や小頭症などの症状を伴う症例も多くあった。このことは、PQBP1が脳の高次機能以外にも多角的な役割を持っていることを示唆している。
- 注5) トランスポゾン
- ゲノム上を転移することができる遺伝子であり、トウモロコシの斑形成の原因として1940年にバーバラ・マクリントックが発見した。この成果によって彼女は1983年にノーベル賞を受賞している。ヒト、ショウジョウバエなどにも存在し、ヒトでは遺伝病の原因にもなることが知られている。ショウジョウバエではトランスポゾンを利用してランダムに遺伝子をつぶす遺伝子変異ライブラリー作成が行われている。
- 注6) HDAC阻害剤
- 通常、核内でDNAは、ヒストンというたんぱく質に巻きついたヌクレオソームと呼ばれる安定した構造を取っている。遺伝子発現の過程において、ヒストンのアセチル化によりヌクレオソーム構造がほぐされ、転写が開始されることが知られている。
- ヒストンデアセチラーゼ(HDAC)は、アセチル化されたヒストンからアセチル基を取り除く働きを持つ酵素であり、HDAC阻害剤は、このHDACの働きを阻害する薬剤である。HDACの阻害によりヒストンのアセチル化が亢進してヌクレオソーム構造がほぐされ、さまざまな遺伝子の発現が変化することが分かっている。
<論文名>
“Drosophila PQBP1 regulates learning acquisition at projection neurons in aversive olfactory conditioning”
(ショウジョウバエPQBP1は忌避的におい条件付けにおける学習獲得を投射ニューロンにおいて制御する)
doi: 10.1523/JNEUROSCI.1319-10.2010
<お問い合わせ先>
<研究に関すること>
岡澤 均(オカザワ ヒトシ)
東京医科歯科大学 難治疾患研究所 神経病理学分野 教授
〒113-8510 東京都文京区湯島1-5-45
Tel:03-5803-5847 Fax:03-5803-5847
E-mail:
<JSTの事業に関すること>
長田 直樹(ナガタ ナオキ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: