<ポイント>
○ 1970年代初頭から不明であったQβウイルス注1)の宿主(しゅくしゅ)注2)である大腸菌の翻訳因子の役割を解明
○ 宿主翻訳因子がウイルスRNA注3)合成酵素複合体の活性部位構造形成を促進
○ 宿主翻訳因子がウイルスRNAの合成伸長を促進する役割
独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)バイオメディカル研究部門【研究部門長 織田 雅直】RNAプロセシング研究グループ 富田 耕造 研究グループ長、竹下 大二郎 専門技術者(財団法人 日本産業技術振興協会)らは、ウイルス由来のRNA合成酵素と、宿主由来の翻訳因子注4)との複合体の構造を世界で初めて解明した(図1)。
今回、大腸菌に感染するQβウイルス由来のβ-サブユニット注5)(RNA合成酵素に相当)と、宿主由来の2つの翻訳因子との三者複合体の構造解析および機能解析により、複合体形成やRNA合成における翻訳因子の役割の分子的基盤が明らかになった。今後、ウイルスのRNAゲノム注6)複製を担う複合体の形成を阻害することによる新たな抗ウイルス薬の開発につながるものと期待される。
本研究は独立行政法人 科学技術振興機構(JST)戦略的創造研究推進事業 個人型研究(さきがけ)「RNAと生体機能」【研究総括 微生物化学研究所長 野本 明男】研究領域における研究課題「RNA末端合成プロセス装置の分子基盤」【研究者 富田 耕造】の一環として行われた。また、独立行政法人 日本学術振興会(JSPS)基盤研究A、文部科学省 特定領域研究公募研究からの研究費補助金による支援も受けている。本成果は、2010年8月23日(米国東部時間)に、米国科学アカデミー紀要(PNAS)のオンライン版に掲載される。
<開発の社会的背景>
1970年代初頭に、大腸菌に感染するQβウイルスのQβ複製複合体注7)の形成には、大腸菌に由来する翻訳因子EF-Tu注8)とEF-Ts注8)が不可欠であることが報告された。その後、いくつかの動物、植物、バクテリアに感染するRNAウイルスのゲノムRNA上にコードされているRNA依存性RNA合成酵素(RdRp)注9)が、宿主の翻訳因子と複合体を形成し、その複合体がRNAウイルスゲノムの複製・転写注10)に必要であることが報告されてきた。しかしながら、RdRpが宿主由来の翻訳因子と複合体を形成する分子機構や、複合体中の翻訳因子の役割については不明のままであった。ウイルス由来のRNA合成酵素と宿主由来の翻訳因子との複合体形成やRNAウイルスゲノムの複製・転写における宿主翻訳因子の役割の分子的基盤を解明することは、新たな抗ウイルス薬の開発につながると期待されているため、国内外で研究が進められてきた。
<研究の経緯>
産総研らはここ数年、RNA合成システムの機能構造基盤研究を進めてきた。特に核酸性の鋳型注11)を用いないRNA合成酵素の反応機構解明において、世界有数の研究成果を発信してきた(産総研プレス発表など:2006年10月16日、2008年7月8日、2009年10月5日)。今回、核酸性の鋳型を用いてRNAを合成するウイルス由来のRNA合成酵素のうち、大腸菌に感染するQβウイルス由来のRNA合成酵素とQβウイルス感染細胞内の翻訳因子(EF-Tu、EF-Ts)との複合体形成機構やRNA合成における翻訳因子の新たな役割の解明をめざし、エックス線結晶構造解析と機能解析を行った。
<研究の内容>
本研究で対象としたQβウイルスは一本鎖のRNAをゲノムとして有するウイルスであり、Qβ複製複合体によってそのRNAゲノムの複製・転写を行う。Qβ複製複合体は、他のRNAウイルスではRdRpに相当するβ-サブユニットと、宿主由来の翻訳因子EF-Tu、EF-Ts、およびリボソームタンパク質S1注12)から構成される。特にQβ複製複合体によるRNA複製・転写活性にはβ-サブユニットと宿主由来の翻訳因子EF-Tu、EF-Tsとが三者複合体を形成することが必要である。β-サブユニットとEF-Tu、EF-Tsとの三者複合体のエックス線結晶構造解析と機能解析を行った結果、以下のことが明らかになった。
- 1) Qβウイルス由来のβサブユニットと翻訳因子EF-Tu、EF-Tsとの複合体はボートのような形をしており、β-サブユニットと翻訳因子EF-Tu、EF-Tsとは1:1:1の比率で、主に疎水的な相互作用注13)で複合体が形成されていた(図2、3)。
- 2) β-サブユニットは通常のウイルス由来のRNAを鋳型として用いるRNA合成酵素と同様に、サムドメイン、パームドメイン、フィンガードメイン注14)の3つのドメインからなる構造をしていた(図3)。
- 3) 翻訳因子EF-TuとEF-Tsは強固な複合体を形成し、EF-Tuのドメイン2と呼ばれる領域はβ-サブユニットのフィンガー領域、EF-Tsのコイルド-コイルドメイン注15)と呼ばれる領域はβ-サブユニットのサムドメインと疎水的な相互作用をしており、これら翻訳因子とβ-サブユニットとの相互作用によって、RNA合成複合体のRNA合成触媒中心注16)構造が維持されていた(図3)。
- 4) 翻訳因子との相互作用を破壊すると、β-サブユニットとの複合体形成が阻害され、また、β-サブユニットの発現も著しく抑えられることが示された。
- 5) 複合体の構造中に鋳型RNAおよび基質であるリボヌクレオチド注17)が入っていく、RNA合成触媒中心へと通じるトンネルをそれぞれ同定した(図4)。
- 6) 複合体の構造中への鋳型RNA、それに相補的な合成されたRNAの二本鎖RNAの結合モデルから、RNA合成伸長過程において、鋳型と合成されたRNAからなる二本鎖RNAは複合体中のEF-Tu、EF-Tsの方向へ伸長することが示された(図4)。
- 7) ウイルスゲノムRNAの効率的な複製、転写には、鋳型と合成されたRNAからなる二本鎖RNAの構造を変化させる必要があり、複合体中のEF-Tu、EF-Tsは、二本鎖RNAをほどく機能があることが示唆された。
以上の結果から、ウイルス由来のRNA合成酵素の機能発現において、宿主由来の翻訳因子はRNA合成触媒中心構造を維持するために必要なタンパク質シャペロン注18)として働いていることを提唱した。さらに、RNA合成伸長モデルから、翻訳因子はウイルスRNAゲノムの合成伸長反応を効率よく行うために、鋳型RNAと合成されたRNAの二本鎖RNAをほどいてRNAの構造を変化させる新機能を有していることをも提唱した。
なお、本研究で明らかになった複合体の構造は、世界で初めてのウイルス由来のRNA合成酵素と宿主タンパク質との複合体の構造であると同時に、翻訳因子が翻訳サイクル以外の過程で機能する様子を捉えたものでもある。また、ウイルスの感染細胞での増殖は宿主のタンパク質に依存しているが、今回、明らかになった分子的基盤により、ウイルス由来のRNA合成酵素と宿主由来のタンパク質との複合体形成を阻害することによって、ウイルスの増殖を阻害することが可能な新たな抗ウイルス薬の開発が期待される。
<今後の予定>
今後、ウイルス由来のRNA合成酵素と宿主由来の翻訳因子との複合体が、RNAウイルスゲノムの合成を開始しRNAを伸長合成していく様子を捉えたエックス線結晶構造解析と機能解析を行い、ウイルスゲノムRNAの複製・転写における翻訳因子の詳細な動的反応の分子的基盤を明らかにしていきたい。
<参考図>
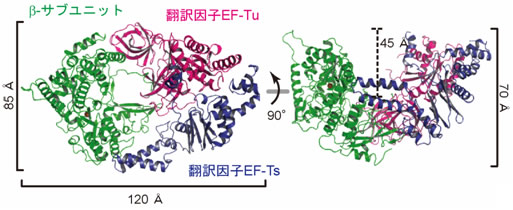
図1 ウイルス由来のβ-サブユニット(緑)と宿主由来の翻訳因子(赤、青)との複合体の構造
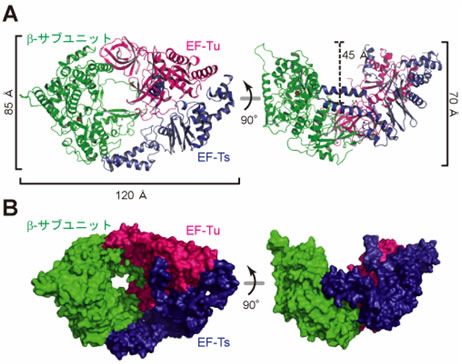
図2 Qβウイルス由来のβ-サブユニット(緑)と翻訳因子EF-Tu(赤)、EF-Ts(青)との複合体の構造
リボンモデル(A)、サーフェスモデル(B)。右図は左図を90度回転させたもの。複合体がボート形をしていることが分かる。
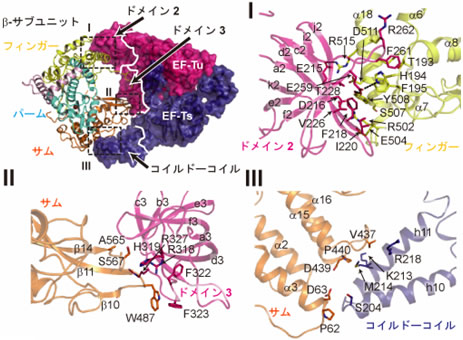
図3 Qβウイルス由来のβ-サブユニットと翻訳因子EF-Tu、EF-Tsとの相互作用
主にI、II、IIIの三箇所で相互作用し、EF-Tuのドメイン2、3はそれぞれβ-サブユニットのフィンガードメイン、サムドメインと、EF-Tsのコイルド-コイルドメインはβ-サブユニットのサムドメインと疎水的な相互作用をする。
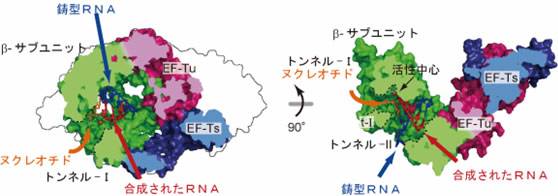
図4 QβウイルスRNA合成酵素複合体中の基質トンネル、およびQβウイルスRNA合成酵素複合体中への鋳型RNAと合成されたRNAの結合モデル
合成されたRNAと鋳型RNAの二本鎖RNAは複合体中のEF-Tu、EF-Tsの方向へ伸長していく。
<用語解説>
- 注1) Qβウイルス
- 一本鎖RNAをゲノムとして有し、大腸菌に感染して増幅するウイルスの一種。
- 注2) 宿主
- 一般に、ウイルスは自分自身では増殖できず、他の生物に感染して、その生物のもつタンパク質などの助けを借りて増殖する。この感染先の生物、細胞のことを宿主と呼ぶ。
- 注3) RNA
- 核酸にはDNAとRNAが存在する。DNAはA、G、C、Tの4種類の構成要素(ヌクレオチド)が連結したものであり、一方RNAはA、G、C、Uの4種類のヌクレオチドが連結したものである。
- 注4) 翻訳因子
- 生体内でのタンパク質の合成を翻訳という。タンパク質はDNA(あるいはRNA)の配列を基にして、遺伝暗号によってリボソームと呼ばれる超複合体にてアミノ酸が連結されたタンパク質へと変換される。翻訳因子は、タンパク質の翻訳過程に関与するタンパク質のことをいう。
- 注5) サブユニット
- いくつかの構成因子(ユニット)からなる複合体のなかの1つのユニットのことをさす。
- 注6) ゲノム
- 生物のもつ遺伝情報が記載されている核酸。通常の生物はDNAをゲノムとして有するが、他の生物に寄生して自己増殖するウイルスでは、RNAをゲノムとして有するものがある。
- 注7) Qβ複製複合体
- QβウイルスゲノムRNAの複製や転写を行う酵素複合体。
- 注8) EF-Tu、EF-Ts
- EF-Tu、EF-Tsともに翻訳伸長因子であり、全ての生物に存在する。EFはElongation Factorの略である。EF-Tuはアミノ酸の結合したtRNAをリボソームと呼ばれるタンパク質合成装置へ運搬する役割を果たしており、一方EF-TsはEF-Tuをリサイクルする役割を果たしている。いずれの因子もタンパク質の合成サイクルに必須なタンパク質である。
- 注9) RNA依存性RNA合成酵素(RdRp)
- 鋳型としてRNAを用いて(RNA配列に依存して)、それに相補的なRNA配列を合成する酵素。
- 注10) 複製・転写
- ある核酸(DNA、RNA)の配列があるとき、その配列と全く同じ配列の核酸を合成することを複製という。また、ある核酸(DNA、RNA)の配列の相補的な配列を合成することを転写と呼ぶ。
- 注11) 核酸性の鋳型
- 生体内での核酸(DNAやRNA)の合成は通常、その青写真となる核酸配列が存在し、塩基の相補性と呼ばれる規則に従って行われる。青写真の配列を鋳型と呼び、合成される配列は青写真と相補的である。
- 注12) リボソームタンパク質S1
- 生体内でのタンパク質合成はリボソームと呼ばれる巨大な複合体で行われる。リボソームは数十種類のタンパク質と3つのRNAから構成される。リボソームタンパク質S1はリボソームを構成するタンパク質の一種。
- 注13) 疎水的な相互作用
- 水になじみにくい部分をもったタンパク質間(あるいはタンパク質の部位間)に働く引力的相互作用を表す。疎水的の逆は親水的。
- 注14) サムドメイン、パームドメイン、フィンガードメイン
- RNA合成酵素のいくつかのものは、右手で言い表される構造をとっていることが知られており、3つの構成ドメインからなる。サム、パーム、フィンガーはそれぞれ、thumb(親指)、palm(手のひら)、finger(指)を表す。
- 注15) コイルド-コイルドメイン
- コイルが2つ直列に連結された構造のことを表す。
- 注16) RNA合成触媒中心
- RNAの合成はリボヌクレオチドが連結される化学反応である。このRNA合成の化学反応を促進する部位のことを触媒中心という。
- 注17) リボヌクレオチド
- RNAを構成するヌクレオチドのこと。
- 注18) タンパク質シャペロン
- タンパク質がその機能を発現するためには、正しく折りたたまれて、正しい構造をとることが必要である。タンパク質シャペロンは、他のタンパク質が正しい構造をとるのを助ける役割をもつタンパク質の総称である。
<お問い合わせ先>
<研究に関すること>
富田 耕造(トミタ コウゾウ)
独立行政法人 産業技術総合研究所 バイオメディカル研究部門 RNAプロセシング研究グループ 研究グループ長
〒305-8566 茨城県つくば市東1-1-1 中央第6
Tel:029-861-6085 Fax:029-861-6095
E-mail:
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)
独立行政法人 科学技術振興機構 イノベーション推進本部 研究推進部(さきがけ担当)
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3525 Fax:03-3222-2067
E-mail:
<プレス発表/取材に関する窓口>
小林 達哉(コバヤシ タツヤ)
独立行政法人 産業技術総合研究所 広報部 広報業務室
〒305-8568 茨城県つくば市梅園1-1-1 中央第2 つくば本部・情報技術共同研究棟8F
Tel:029-862-6216 Fax:029-862-6212
E-mail:
独立行政法人 科学技術振興機構 広報ポータル部
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: