JST 課題解決型基礎研究の一環として、大阪大学 大学院生命機能研究科の上田 昌宏 特任教授らは、細胞の自発運動を司るシグナル分子の自己組織化注1)過程を解明しました。
細胞は外部からの刺激がない一様な環境でも、不規則に方向転換しながら運動する「自発性」を持っています。この細胞が自発的にゆらぐ運動は、外部環境からのシグナルに依存せずに、細胞内部で生成される自発シグナルによって制御されると考えられます。これまで、アメーバ様細胞の運動は、イノシトールリン脂質注2)の一種であるホスファチジルイノシトール3、4、5-三リン酸[PI(3、4、5)P3]が細胞膜上で偏って集積し、PI(3、4、5)P3が細胞の運動を司るアクチン骨格系注3)を制御することによって起こることが知られていました。しかしながら、PI(3、4、5)P3が偏って存在する仕組み、特に、PI(3、4、5)P3の合成と分解を担うイノシトールリン脂質代謝系が調節される仕組みは明らかにされていませんでした。
本研究グループは、今回、イノシトールリン脂質代謝系の自己組織化によってPI(3、4、5)P3の偏り(極性)が形成されることを発見し、この自己組織化が細胞の自発運動に重要であることを明らかにしました。この自己組織化はPI(3、4、5)P3の代謝に働くホスファチジルイノシトール3-キナーゼ(PI3K)やピーテン(PTEN)などの酵素分子の反応ネットワークによって形成され、緩和振動注4)と呼ばれる特徴的な経時変化を示すことが分かりました。この反応ネットワークを数理モデル化することにより、実験的に観察された緩和振動をシミュレーションで再現することに成功しました。数理モデルの解析から、PI3KやPTENなどの酵素分子の反応が不規則に変動する(ゆらぐ)ことにより、自己組織化パターンが多様になり、それによりランダムな細胞運動が引き起こされることが示唆されました。このように、イノシトールリン脂質代謝系は分子反応が確率的に変動することを織り込みながら細胞極性を自己組織化しているため、分子反応の確率的な変動というノイズの影響を受けにくい、ロバスト(頑強)なシステムとなっていると考えられます。また、イノシトールリン脂質代謝系に内在する分子反応の確率的なゆらぎの影響を消し去るのではなく、多様な時空間パターンの形成に利用することにより、ランダムな運動を自発生成していると考えられます。
本研究の進展により、自己組織化のコンセプトに基づいて分子反応のゆらぎを利用・制御する細胞内メカニズムが明らかとなり、ゆらぐ分子を要素として構成された生体システムに固有の設計原理・演算原理の解明に役立つことが期待されます。
本研究は、広島大学 准教授の柴田 達夫 氏と共同で行われました。
本研究成果は、「米国科学アカデミー紀要(PNAS)」のオンライン速報版で2010年6月14日(米国東部時間)の週に公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
: |
「生命システムの動作原理と基盤技術」
(研究総括:中西 重忠 (財)大阪バイオサイエンス研究所 所長)
|
| 研究課題名 |
: |
「細胞における確率的分子情報処理のゆらぎ解析」 |
| 研究代表者 |
: |
上田 昌宏(大阪大学 大学院生命機能研究科 特任教授) |
| 研究期間 |
: |
平成19年10月~平成25年3月 |
JSTはこの領域で、生命システムの動作原理の解明を目指して、新しい視点に立った解析基盤技術を創出し、生体の多様な機能分子の相互作用と作用機序を統合的に解析して、動的な生体情報の発現における基本原理の理解を目標としています。上記研究課題では、分子運動の無秩序さや反応の確率性に起因するノイズの生成・処理・伝搬に着目した1分子レベルの精密計測と数理モデルの構築を通して、分子情報処理システムの確率的演算原理の解明を目指しています。
<研究の背景と経緯>
細胞は外部刺激がなくても極性を形成し、方向転換を繰り返しながら自発的に移動運動を行います。つまり、細胞には前側と後ろ側があり、移動の際は前側を先頭にして進むということです。このことは、細胞の運動方向、すなわち細胞の前後極性を決定するシグナルが外部環境に依存せずに細胞内で生成されることを意味しています。自発性のメカニズムとして、これまでバクテリアやゾウリムシなどの水中を遊泳する細胞を用いた研究から、分子の数や活性の確率的なゆらぎが重要であることが示唆されていました。一方、細胞性粘菌や白血球などのように、基質上に接着し運動に伴って細胞形態が動的に変化するアメーバ様細胞においては、細胞極性を形成するために、自発シグナルが細胞内で特定の分布をもつように組織化される必要があります。
細胞極性を制御するシグナル分子としては、外部刺激に対する走化性注5)応答の研究から、イノシトールリン脂質の一種であるPI(3、4、5)P3が知られていました。細胞中のPI(3、4、5)P3量は、PI(3、4、5)P3を合成、分解する酵素であるPI3KとPTENの活性によって調節されています。走化性を示す細胞では、PI(3、4、5)P3が外部刺激に応じて細胞前端の細胞膜に蓄積しており、こうしたPI(3、4、5)P3の極性によって走化性が維持されています。しかし、外部刺激がないときに、どのようにしてPI(3、4、5)P3が細胞内部の働きによって自発的に極性化されるのかについては、明らかではありませんでした。
<研究の内容>
細胞膜上でのPI(3、4、5)P3の経時変化や分布パターン(時空間パターン)を明らかにするために、イノシトールリン脂質代謝系を構成する分子のマルチカラーイメージング解析を行いました。実験には、細胞運動や走化性応答の研究がよく進んでいる細胞性粘菌Dictyostelium discoideum(和名:キイロタマホコリカビ)のアメーバ細胞を用いました。イメージング解析の結果、PI(3、4、5)P3の細胞内局在がイノシトールリン脂質代謝系の自己組織化によって形成されることが明らかになりました。
自発運動をしている細胞では、PI(3、4、5)P3は細胞の前端に局在し、そこで細胞の運動を司るアクチン骨格系を制御することで自発運動が起こると考えられています。この自発的に運動する細胞のアクチン細胞骨格の働きを薬剤で阻害して細胞の移動運動を抑制したところ、細胞が動けない状態であるにも関わらずPI(3、4、5)P3が局在していることを発見しました(図1)。このことは、アクチン細胞骨格に非依存的な自己組織化のメカニズムがあることを意味しています。PI(3、4、5)P3が存在するところにはPTENはほとんど存在しておらず、両者は相互に排他的な局在を維持しながら細胞膜上を伝搬する進行波注6)(図1、図2A)を形成していました。また、他の細胞では、周期的にPTENとPI(3、4、5)P3の局在場所が入れ換わる振動(図2B)が観察されました。これらの時空間パターンはPI3KとPTENの活性に依存しており、これらの酵素活性の阻害によりパターン形成が抑制されると、細胞の自発運動能も著しく阻害されました。つまり、イノシトールリン脂質代謝系の自己組織化が細胞の自発運動のシグナルを生成していることが分かりました。また、個々の細胞が示すイノシトールリン脂質代謝系の時空間パターンは、見かけ上は細胞ごとに異なっていますが、細胞間で共通したダイナミクスが存在することが明らかになりました(図3)。このダイナミクスは生物の振動現象でしばしば見つかる緩和振動の特徴を持っていました。さらに、PI3KおよびPTENの分子反応を含めた反応拡散方程式注7)に基づいて、これらの現象を再現可能な数理モデルの構築に成功しました(図4)。この数理モデルの解析から、細胞で見られる多様な時空間パターンが、分子数などのわずかな変化によって生み出されていることが明らかになりました。今回明らかになった自己組織化のメカニズムは、イノシトールリン脂質代謝系の分子反応ネットワークに内在する分子反応の確率的なゆらぎの中で細胞極性を比較的安定して生成しつつ、一方で、確率的なゆらぎからランダムに時空間パターンを生み出すことを可能にしています。こうした確率的にゆらぐ分子反応ネットワークの自己組織化により、細胞全体として分子反応のゆらぎに対して頑強(ロバスト)な挙動が可能になるとともに、ランダムな運動を自発生成していると考えられます。
<今後の展開>
本研究により、生体システム特有の分子反応の確率性に起因するゆらぎが自己組織化のメカニズムにより制御・利用できることが明らかとなりました。同様の動作メカニズムは、生体内の細胞においても利用されていることが想像されます。例えば、白血球の示す免疫応答や神経細胞による神経回路形成などにおいても走化性が重要であることが知られています。免疫応答では、白血球は排除するべき異物に向かって進み、神経回路が秩序だって形成される際には、どの神経細胞同士が結合するかが調節されています。このとき細胞は、生体内の複雑な空間構造において微弱な化学物質の濃度勾配の情報をたよりに目的地にまで移動する必要があります。ここでも、自己組織化によって自発的に細胞極性を形成しておき、外部刺激に応じて適宜細胞極性の方向性に対しバイアスをかけることで、細胞の移動方向を制御する仕組みが働いている可能性があります。また、高等生物においては、イノシトールリン脂質代謝系を構成する分子(PI3KやPTENなど)の突然変異により細胞ががん化する場合があることが知られていますが、今回明らかとなったイノシトールリン脂質代謝系の自己組織化能が細胞のがん化やその抑制に関与している可能性があります。このように、本研究において提案した自己組織化に基づく細胞内分子反応ネットワークの制御機構は、より複雑な生体内で起こる細胞の運動や応答、疾患の解明につながることが期待されます。
<参考図>
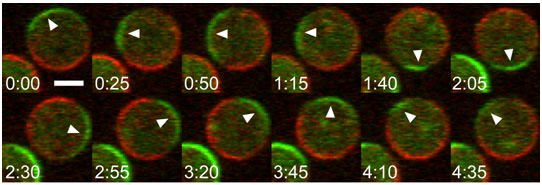
図1 細胞が自己組織化反応により自発的にPI(3、4、5)P3極性を形成する様子
イノシトールリン脂質代謝系分子の細胞内局在(緑:PI(3、4、5)P3結合たんぱく質であるPHドメインたんぱく質、赤:PTEN)。両たんぱく質に蛍光色素を付加して、アクチン細胞骨格を阻害した細胞の水平断面を可視化した。円周にあたる細胞膜上において、局在領域が時間経過に伴って移動する様子が観察された。(単位、分:秒。スケールバーは5μm)
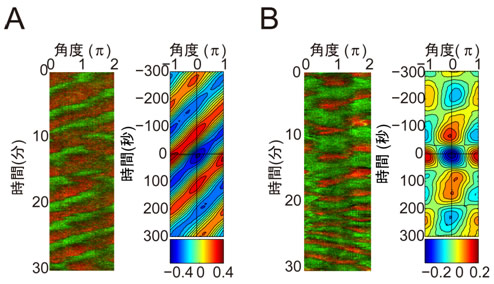
図2 細胞ごとのPI(3、4、5)P3局在の時空間パターンの違い
A、Bは異なる細胞でのPI(3、4、5)P3とPTENの局在を観察した結果である。
A、Bそれぞれにおいて、左図は細胞膜上での各たんぱく質の濃度を示している(赤:PTEN、緑:PI(3、4、5)P3に結合するPHドメインたんぱく質)。横軸は細胞膜上での位置、縦軸は時間を示し、こうした画像はキモグラフと呼ばれ、空間的な局在パターンの時間変化を捉えることができる。右図は相互相関関数を示しており、キモグラフにおいて、時間・空間的にどの程度の周期で似た構造が出現しやすいかを示している。相関の度合いは赤から青の色相で表示した(右下参照)。Aは進行波の特徴を示し、Bは振動と呼ばれる特徴を示す。
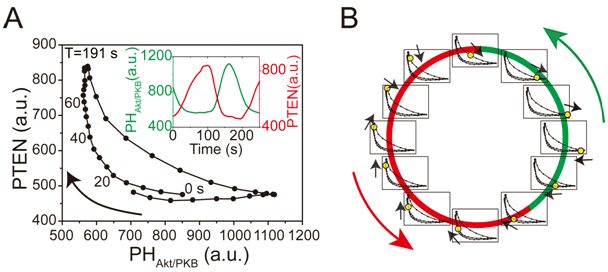
図3 イノシトールリン脂質代謝系の緩和振動ダイナミクス
- A: 細胞膜上のPI(3、4、5)P3とPTEN濃度の時間変化の平均的挙動。PTEN濃度が高くPI(3、4、5)P3濃度は低い、あるいは、PTEN濃度が低くPI(3、4、5)P3濃度が高いという2種類の状態が比較的安定であり、細胞はその状態間を矢印の向きで行き来していることが明らかになった。
- B: 進行波の起こる仕組み。細胞膜上の各点での緩和振動ダイナミクスは共通であるが、その振動の位相が各点で少しずつずれているために、全体では進行波として見える。緩和振動ダイナミクスの形成に働くPTENは、細胞膜から離れると細胞質に移行し、また細胞膜の別の場所に結合する。このため、細胞膜上の各点は、PTENを介して細胞全体と相互作用することになる(グローバルカップリング)。この相互作用を通して、細胞膜上の各点の位相に差が生まれ、進行波や振動が形成される。細胞によってイノシトールリン脂質代謝系の分子の量が異なるために、細胞膜上の各点での位相のずれ具合が異なり、進行波と振動の違いや周期の違いが生じると考えられる。
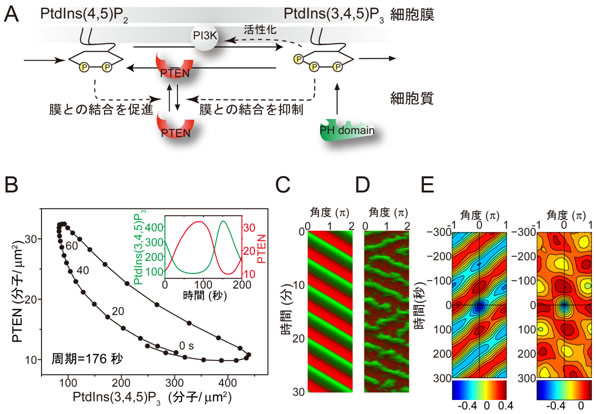
図4 イノシトールリン脂質代謝系の反応拡散方程式に基づいた数理モデルによる再構築
- A: 数理モデルに含まれるPI(3、4、5)P3代謝反応とPTENの細胞質-細胞膜間移行。PTENはPI(3、4、5)P3を脱リン酸化してPI(4、5)P2を産生する。逆に、PI3KはPI(4、5)P2をリン酸化してPI(3、4、5)P3を産生する。PTENは細胞質と細胞膜の間を行き来しているが、PI(3、4、5)P3が多くあるとPTENを細胞質へ移行させる。このため、PI(3、4、5)P3が多い細胞膜では、PTENの濃度が下がり、PI(3、4、5)P3の脱リン酸化が減るため、ますますPI(3、4、5)P3が増えることになる。逆に、いったんPI(3、4、5)P3が減少し始めると、PTEN濃度が増加し、ますますPI(3、4、5)P3が減少する。こうした正のフィードバックによりPI(3、4、5)P3とPTENが逆位相になる振動が形成される。
(図中 PtdIns(4,5)P2=PI(4、5)P2、PtdIns(3,4,5)P3=PI(3、4、5)P3)
- B: 再構築された緩和振動ダイナミクス。(緑:PI(3、4、5)P3)
- C: 分子反応ゆらぎを含めないシミュレーションによって再現された時空間パターン。
- D: 分子反応ゆらぎを含めたシミュレーションによって再現された時空間パターン。実際の細胞のキモグラフ(図2)と同様に、パターンが途中で消失したり進行波が逆転したりする様子が再現された。
- E: 分子反応ゆらぎを含めたシミュレーションによって進行波(左)と振動(右)が再現された。この場合、PI(4、5)P2の供給速度を変えることによって2つのパターンが生じた。
<用語解説>
- 注1) 自己組織化
- 複数の分子間の相互作用により、時間空間的に一様な状態から自発的に進行波や緩和振動などの時間・空間的な秩序やパターンが形成されること。
- 注2) イノシトールリン脂質
- 細胞膜に存在するリン脂質であり、細胞膜全体に占める構成比は低いが、さまざまなシグナル分子の活性調節を介して細胞骨格制御、分泌、小胞輸送、核への情報伝達などの細胞機能を調節している。また、PTENは腫瘍抑制因子であり、この代謝系の異常ががんの発生に関与していることが知られている。
- 注3) アクチン骨格系
- 細胞の運動装置として働く細胞骨格。アクチンを主成分として種々のアクチン結合たんぱく質やミオシン分子を含む。これらの分子の相互作用により、細胞の運動装置である仮足や尾部が形成される。細胞の前端部では仮足が前方へと形成され、後端部では尾部が収縮することにより、細胞が運動する。
- 注4) 緩和振動(relaxation oscillation)
- ゆっくりとした濃度変化の後に急激な濃度上昇が起こり、その後、再び別のゆっくりとした濃度変化が起こり、今度は急激な濃度下降が起こって元の状態に戻り、これが周期的に繰り返される現象で、反応拡散方程式によって記述することができる。急激な変化によってある状態が別の状態に「緩和」されるので緩和振動と呼ばれる。
- 注5) 走化性
- 細胞が示す外部刺激に対する走性応答の1つで、化学物質の濃度勾配方向に応じて、その濃度の高いあるいは低い方向へ移動運動する性質。
- 注6) 進行波
- 濃度の高い領域が時間の経過とともに波として空間を伝播していく現象で、反応拡散方程式によって記述することができる。
- 注7) 反応拡散方程式
- 化学反応と分子の拡散によって起こる、分子の濃度の時間・空間的な変化を定量的に記述する方程式。自己組織化現象は反応拡散方程式によって再現することができる。
<論文名>
“Self-organization of the phosphatidylinositol lipids signaling system for random cell migration”
(細胞の自発運動を司るイノシトールリン脂質シグナル系の自己組織化)
- 著者:
- 新井 由之(大阪大学 大学院生命機能研究科 特任助教、現 北海道大学 助教)
- 柴田 達夫(広島大学 大学院理学研究科 准教授)
- 松岡 里実(大阪大学 大学院生命機能研究科 特任研究員)
- 佐藤 雅之(大阪大学 大学院生命機能研究科 特任研究員)
- 柳田 敏雄(大阪大学 大学院生命機能研究科 特任教授)
- 上田 昌宏(大阪大学 大学院生命機能研究科 特任教授)
doi: 10.1073/pnas.0908278107
<お問い合わせ先>
<研究に関すること>
上田 昌宏(ウエダ マサヒロ)
大阪大学 大学院生命機能研究科
〒565-0871 大阪府吹田市山田丘1-3
Tel:06-6879-4632 Fax:06-6879-4634
E-mail:
<JSTの事業に関すること>
長田 直樹(ナガタ ナオキ)
科学技術振興機構 イノベーション推進本部 研究領域総合運営部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: