| 3.立体構造の解析結果から明らかになったこと |
| 今回解明した構造は、トロポニン分子から(トロポミオシンとの結合に使われる)「のりしろ」を除いた機能部分です。この部分はTnC, TnI, TnTの3つのポリペプチド鎖から成り立っており、以下「中核部分」と呼ぶことにします。これまで知られていたトロポニンの構造は、TnC単独の構造と、TnCにTnIの一部が結合している構造だけでした。今回の構造ではじめて3つのポリペプチド鎖の位置関係が明らかになりました。トロポニンの「中核部分」はさらに複数の部分構造(サブドメイン)に分かれ、部分構造同士は柔らかく連結されています。この柔らかい連結は、カルシウム結合に伴ってトロポニン自身の構造が、またトロポニンと他のタンパク質との結合が大きく変化することを示唆しているように思われます。
|
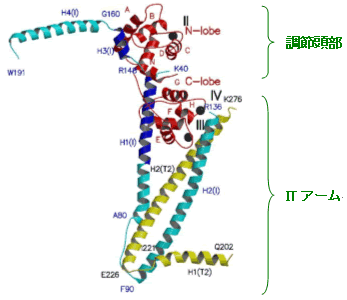 |
図3 トロポニン・コアドメイン(Tn52kB)の結晶構造
トロポニン「中核部分」の結晶構造をリボンモデルで示す。TnCを赤、TnTを黄色、TnIを水色(一部TnC結合領域を青色)で示し、結合している3つのカルシウムイオンを黒い球で示す。「中核部分」はさらに「調節頭部(Regulatory head)」と「ITアーム(IT-arm)」の2つの部分構造(サブドメイン)に分かれる。 |
|
| (1) TnT、TnCおよびTnI3つのサブユニットの相互作用 |
| トロポニンの「中核部分」は2つの部分構造(サブドメイン)、「調節頭部」と「ITアーム」に分かれます(図3)。興味深いことに、部分構造(サブドメイン)の境界とポリペプチド鎖(サブユニット)の境界はまったく一致しません。例えば「ITアーム」では3つのポリペプチド鎖が複雑に絡み合っています。逆にTnTとTnIは単独で部分構造(サブドメイン)を形成しないことが初めて明らかになりました。大きな複数のポリペプチド鎖から成る複合体タンパク質はふつうそれぞれのポリペプチド鎖ごとにまとまった構造をとりますが、トロポニンの「中核部分」では、そのようになっていません。
|
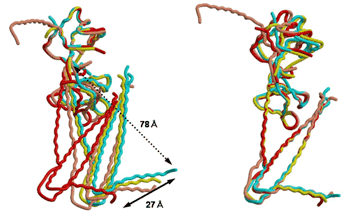 |
図4 4つのトロポニン分子の構造の重ね合わせ
2種類の結晶(Tn52kおよびTn46k)より得た計4分子を対応する部分構造(右は「調節頭部」、左は「ITアーム」)ごとに重ね合わせた。2つの部分構造の間の角度が大きく異なる。 |
|
| (2) 部分構造(サブドメイン)間の連結は柔軟で動きやすい |
今回、2種類の結晶中にそれぞれ「姿勢」の異なる2つの分子の構造を得ることができました。得られた合計4分子の構造を比較すると「調節頭部」と「ITアーム間」の角度が分子ごとに大きく異なり(図4)、この2つの部分構造(サブドメイン)間の連結が柔軟であることが分かりました。すなわち、複数の部分構造(サブドメイン)から構成されるトロポニン分子は柔軟に動くことができることを示唆します。
|
| (3) 結合したカルシウムイオンの役割 |
心筋トロポニンには「調節頭部」に1つ(骨格筋トロポニンでは2つ)、「ITアーム」に2つのカルシウム結合部位があります。前者(結合部位II)へのカルシウムイオンの結合・解離が筋収縮・弛緩のスイッチとして機能しているのに対し、後者(結合部位IIIおよび結合部位IV)は筋細胞中で常にカルシウムイオンあるいはマグネシウムイオンを結合し分子の安定化に関わっていると考えられていました。今回得た構造により、結合部位IIへのカルシウム結合がTnIとTnC間の疎水性結合※6をスイッチする仕組みが解明されました。また結合部位IIIおよびIVへのイオン結合が3つのサブユニットを強く結び付ける役割を担っていることが明らかになりました(図5)。
|
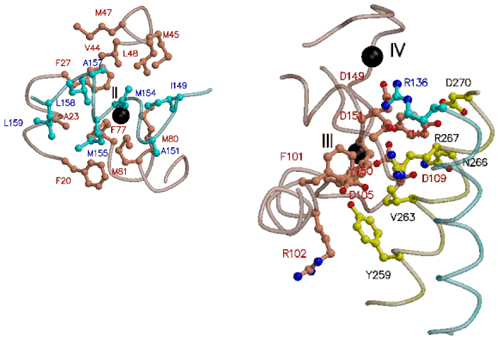 |
図5 結合したカルシウムイオンの役割
左の図は収縮・弛緩の調節に関わるTnCの結合部位(II)に結合したカルシウムイオンとその結果生じるTnCの疎水性領域(茶色)とTnI(水色)の相互作用を示す。
右の図はTnCの結合部位(III)および(IV)に結合したカルシウムイオンを示す。この2つの結合部位は「ITアーム」中でTnC(茶色)、TnI(水色)、TnT(黄色)を束ねる役割を担う。 |
|
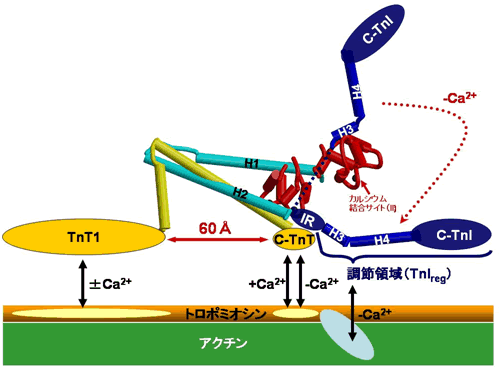 |
| 図6 カルシウムイオンの結合・解離に伴うトロポニンの構造変化と他の筋タンパク質との相互作用の推測図 |
|
| (4) トロポニンの構造変化と収縮調節 |
結合部位(II)へのカルシウムイオンの結合・解離に伴い、TnCとTnIの調節領域(TnIreg)との相互作用が変化すると考えられます(図6)。すなわち、筋の弛緩状態(-Ca2+)では調節領域はTnCから離れアクチンおよびトロポミオシンと相互作用し、トロポミオシンとアクチンの相互作用を強め、その結果モーター分子ミオシン、アクチン間の相互作用を抑制し張力発生を抑えると考えられます。逆に収縮時(+Ca2+)には調節領域はアクチン、トロポミオシンから離れTnCと強く結合することにより抑制を解除し、アクチン・ミオシン間の強い結合が形成され筋は収縮を開始すると考えられます。今回得られた結晶構造にはトロポミオシンとの結合に使われる「のりしろ」は含まれていませんが、2つの「のりしろ」(常にトロポミオシンと結合している2つの領域、TnT1とC-TnT)の位置が約60Å程度離れていること、そのうちの1つの「のりしろ」(C-TnT)と調節領域が近接することが明らかになりました。このことから結合部位(II)へのカルシウム結合のシグナルが「ITアーム」を介し約60Å離れたTnT1に伝わり、その結果アクチン繊維上でトロポミオシンが構造変化することが示唆されました。
|
|
戻る NEXT
|