原子力システム研究開発事業及び原子力基礎基盤戦略研究イニシアティブ 成果報告会資料集
低線量率長期照射による個体レベルでの遺伝子発現変化の解析
(研究代表者)小野哲也 大学院医学系研究科
(再委託先)独立行政法人放射線医学総合研究所
(研究開発期間)平成21年度〜23年度
1.研究開発の背景とねらい
放射線による癌誘発や寿命短縮などの晩発性障害の発生メカニズムについては染色体異常や遺伝子変異などのゲノムの構造変化が重要と考えられてきたが、近年遺伝子発現の変化(エピジェネティックな変化)の重要性も注目され始めている。我々は低線量率放射線を長期照射したマウスでのmRNAと蛋白質の解析から、放射線作業従事者の許容線量(20 mSv/yr)、あるいは宇宙ステーションでの被ばくレベル(数100 mSv/yr)といった非常に低い線量率の放射線でも遺伝子発現が変化することを明らかにした(1、2,3)。しかもその変化からは細胞のストレス防護反応の増強だけでなく肥満や代謝異常といったこれまでに考えられていなかった生体機能の変化に結びつく可能性も示唆された。しかし、これらの変化は照射直後に解析したものであり、見出された変化がその後も長期間保たれるかどうかについては分かっていない。そこでこの点を明らかにするのが本研究の目的である。そもそも遺伝子発現の変化の多くは一時的なものと考えられ、変化のどれ程が持続的変化になるかはほとんど未解明である。この解析によって低線量率放射線によるエピジェネティックな変化がどのようなものかが明らかにできると考えている。解析の手法としてはマイクロアレイ解析、2次元電気泳動、抗体アレイ解析などの網羅的な解析を用い、全体像の把握を目指す。また、低線量率長期照射の影響だけでなく、高線量率短期照射の影響も調べ、両者を比較することにより放射線のエピジェネティックな影響の特性を明らかにしたい。
2.研究開発成果
2.1 高線量率放射線照射による遺伝子発現の変化
2.1.1 脳におけるmRNAの変化
2009年、Loweらはマウスに0.1Gyの放射線を照射した後4時間でみられる脳のmRNAはヒトのアルツハイマー病で変化のみられるmRNAとかなり重複することを報告した(4)。これは0.1 Gyという低線量放射線が脳をアルツハイマーに近いものにするかも知れないとして注目された。我々はまず、この信憑性について確かめるべく、0.1 Gy照射後4時間におけるmRNAの変化を調べた。ただし、Loweらは海馬を含む大脳の1/3をサンプルとして用いたのに対し、我々はアルツハイマー病で最初に変化を示すことが分かっている海馬部位だけを分離してマイクロアレイによる解析をした。その結果、50種類のmRNAに1.5倍以上の変化がみられた。これらの遺伝子の生体内での機能を知るためにIngenuity Pathway Analysisを用いて解析すると27種類の遺伝子から14種類の機能がリストアップされた。これらのうち3種類についてはアルツハイマー病での変化及びLoweらの見出した変化と重複していたが、他の11種類については重複していなかった(図1)。しかも重複している3種類の機能はいずれも細胞の基本的な機能であり、アルツハイマー病での特異性は低いものであった。これらのことから0.1 Gy照射がアルツハイマー様の変化を引き出すというLoweらのデータは追試できないと判断した。
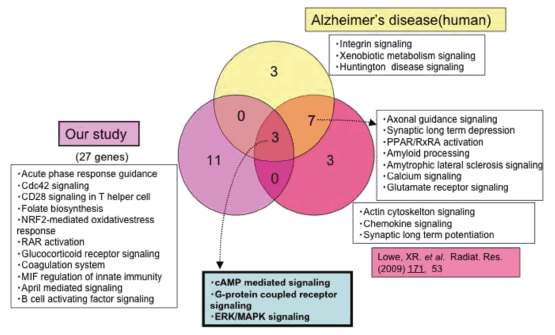
図1. 0.1Gy照射後4時間の時点でみられる海馬でのmRNAの変化から推測された生体機能のリストとアルツハイマー病でみられる変化及び Lowe らのデータの相互比較。
Loweらのデータ(Radiat. Res., 171 53 (2009))及びヒトアルツハイマー病の脳で変化することが報告された機能と比較し、どれほどが重複しているかを示したVennグラフ。Loweらのデータとヒトアルツハイマー病はかなり多くが重なっているが、我々の結果ではアルツハイマーともLoweらの結果とも余り重なっていない。
2.1.2 肝臓でのmRNAの変化
0.1 Gy及び4 Gyの放射線を高線量率(0.72 Gy/min)で照射した後86日(約3ヶ月)を経た時点で肝臓のmRNAを抽出し、マイクロアレイ解析を行った。その結果0.1 Gy照射では33種類のmRNAが1.5倍以上の変化を示し、4 Gy照射では44種類のmRNAに変化がみられた。それらのうち9種類については2つの線量で共通にみられた。これらの結果は0.1 Gy、4 Gyの放射線照射後3ヶ月という期間を経た時点でもmRNAに変化のみられることを示している。ただしここで変化しているmRNAのほとんどは低線量率で400日間照射した時に見られた変化とは異なっていた。このことは長期照射後にみられる変化が、放射線照射後3ヶ月で生じるmRNA変化とは関連性がなく、照射後長時間を経た後二次的あるいは間接的に生じている可能性を示唆している。
2.1.3 肝臓での蛋白質の変化
生体が低線量率で長期に放射線照射された後の生体反応をタンパク質発現変化で検出すべく、平成21年度は対照実験として高線量率、急照射で放射線照射された生体内でのタンパク質発現変化の解析を行った。
2次元電気泳動の解析から、4Gy照射後3ヶ月を経たマウスでコントロール群と比較して顕著な染色強度の増加がみられる2つのスポットを見出した。一つのスポットは調べた3匹の照射マウスで再現性よく染色強度の増加がみられたが、もう一つのスポットについては3個体中1個体で増加が見られなかつた。さらにこれらのスポットについて、質量分析によりタンパク質同定を行った。その結果、3個体に共通して増加していたのはEpoxide hydrolase 2 (cytoplasmic)であり、3個体中2個体で増加がみられたスポットはAldehyde dehydrogenase 1L1と同定された。ウェスタンブロット法による確認、および機能解析については今後の検討課題である。
2次元電気泳動法では検出が困難な微量なタンパク質の発現変化を調べるために抗体アレイを用いた網羅的解析を試み、4Gy照射3ヶ月後と8Gy照射6日後のマウス肝臓から抽出したタンパク質サンプルを用い、対称群と比較した。その結果、8Gy照射6日後と4Gy照射3ヶ月後の両方の群(各々独立した3比較で、計6比較)で共通に発現が増加したタンパク質、および減少したタンパク質をそれぞれ1種類ずつ明らかにした。また4Gy照射3ヶ月後でのみ増加、あるいは減少するタンパク質を数種確認した。その後、解析結果を整理し、タンパクの機能について考察した。その結果、4Gy照射3ヶ月後、および8Gy照射6日後でともに増加したタンパク質はMyD88であり、これは炎症に関わるタンパク質であることが分かった。今回のように放射線照射後の発現誘導についての知見は初めてであるが、放射線防護剤の機能発現に必須のタンパク質であるとする報告もあることから生体防御にも働いている可能性がある。また4Gy照射3ヶ月後でのみ3比較共通して増加したタンパク質は5種あり、その中には炎症性サイトカインを介したアポトーシスの制御に関与するものが4種含まれていた。また4Gy照射3ヶ月後、および8Gy照射6日後で共通して減少していたBclxLは抗アポトーシスタンパク質として知られているものである。照射によるBclxLの減少はアポトーシス誘導につながる可能性がある。また4Gy照射3ヶ月後でのみ共通して減少するタンパク質の3種中2種は細胞周期の進行制御に関わるタンパク質であった。
4Gy照射3ヵ月後のマウスおよび8Gy照射6日後のマウスの肝臓において、発現増加あるいは減少することが抗体アレイの解析によって再現性よく観察されたタンパク質について、その確認と照射後の経過時間による変化を検討するための実験を行った。すなわち、4GyでX線照射後6日目、1ヵ月目、3ヵ月目、および6ヵ月目に肝臓を採取し、抗体アレイで用いたのと同じ抗体(シグマ社)でウェスタンブロット法による解析を開始した。現在までに4Gy照射3ヶ月後、および8Gy照射6日後でいずれも増加しているタンパク質は、4Gy照射6日目でもやはり増加傾向にあり、一方、両条件下で減少しているものは減少傾向であることを観察している。今後、他のサンプルを解析していくことで明確な傾向が現れてくると考えている。
2.1.4 プロモーター等の解析
照射後に発現が変化する遺伝子のプロモータ領域のDNA配列について、共通な配列あるいは共通に作用する転写因子がないかどうかを検索するための解析を行った。これまでに低線量率放射線照射によって発現変動する遺伝子の近傍に有意差をもって多く、あるいは少なく見出される転写因子認識配列としてSREBP-1, Olf-1, GR, HNF-1, AP-4, NF-kappaB, GR, AhR/Ar, Egr-3, Egr-2, E47, Elk-1, Evi-1, S8, HFH-1, Brn-2, HSF1, AP-1, Evi-1, COUP-T等を見出した。その後さらに種々の知見を照らし合わせてこれらの転写因子の関与の信ぴょう性を検討している。
2.2 低線量率長期照射による遺伝子発現の変化
この解析の為に2009年9月から長期照射を始めた。マウスはC57BL/6Jの雄で、線量率は20 mGy/dであり、400日間連続照射を行った後、0日、1日、1週間、1ヶ月、3ヶ月、5ヶ月の時点でサンプリングし、遺伝子発現とタンパク質発現の変化がどう変わってゆくかを追跡する予定である。照射は順調に進んでいる。一部に死亡や体重の異常な増減を示す個体が出てきているが、いずれも想定内のことであり、今後の研究に支障はない。
3.今後の展望
これまでの解析の結果から、以下の3点が明らかになった。(1) 0.1 Gy照射が脳においてアルツハイマー病でみられるmRNAの変化と類似した変化を引き出すことはないと考えられる。(2) 低線量率長期照射後にみられる遺伝子発現の変化は高線量率短期照射後にみられる変化の一部が長期間残るのではなく、照射後二次的あるいは間接的に生じる変化ではないかと推測される。(3) タンパク質発現の変化は高線量率照射では3カ月後で変化が検出されるものが数種あり、炎症やアポト―シスに関わるものであることが推察された。
今後は上記(2)、(3)についてさらに詳細な解析を進めると同時に低線量率長期照射後経時的にmRNAとタンパク質の変化がどう変わるかについて解析し、それらを比較することにより低線量率放射線照射のエピジェネティックな効果の実体を明らかにしたい。
4.参考文献
- T. Nakajima, K. Taki, B. Wang, T. Ono, T. Matsumoto, Y. Oghiso, K. Tanaka, K. Ichinohe, S. Nakamura, S. Tanaka, M. Nenoi, Induction of rhodanese, a detoxification enzyme, in livers from mice after long-term irradiation with low-dose-rate gamma-rays. J. Radiat. Res., 49: 661-666, 2008.
- K. Taki, B. Wang, T. Nakajima, J. Wu, T. Ono, Y. Uehara, T. Matsumoto, Y. Oghiso, K. Tanaka, K. Ichinohe, S. Nakamura, S. Tanaka, J. Magae, A. Kakimoto, M. Nenoi, Microarray analysis of differentially expressed genes in the kidneys and testes of mice after long-term irradiation with low-dose-rayte gamma-rays. J. Radiat. Res., 50: 241-252, 2009.
- Y. Uehara, Y. Ito, K. Taki, M. Nenoi, K. Ichinohe, S. Nakamura, S. Tanaka, Y. Oghiso, K. Tanaka, T. Matsumoto, T. Paunesku, G.E. Woloschak, T. Ono, Gene expression profiles in mouse liver ater long-term low-dose-rate irradiation with gamma rays. Radiat. Res., 174: 611-617, 2010.
- X.R. Lowe, S. Bhattacharya, F. Marchetti, A.J. Wyrobek, Early brain response to low-dose radiation exposure involves molecular networks and pathways associated with cognitive functions, advanced aging and Alzheimer’s disease. Radiat. Res., 171: 53-65, 2009.
