成果等
最終更新:2014年10月10日
Home > 成果等
「進化の機能」を持った人工細胞の作成に成功
研究の内容
研究チームは、遺伝子をコードした人工ゲノムRNAとたんぱく質の翻訳に必要なたんぱく質群を細胞サイズの油中水滴に封入した、人工細胞モデルを構築しました。
ゲノムRNAにはRNAからRNAを複製する酵素の遺伝子がコードされています。研究チームは、このRNAゲノムを数十種類のたんぱく質を含む水溶液とともに油の中で激しくかき混ぜました。その結果、水溶液は約2マイクロメートル(マイクロは百万分の1)の細胞状の水滴として油中に分散しました。この細胞状の各水滴を37度で反応させると、その中ではRNAゲノムにコードされた遺伝子から複製酵素が翻訳され、そして翻訳された酵素は元のゲノムRNAを複製することを見いだしました。この天然の細胞と同じサイズを持ち、天然の細胞と同様に遺伝子の翻訳とゲノム複製機構を持つ水滴を、研究チームは人工細胞と位置づけました。
しかし、天然の細胞とは異なり、この人工細胞内のゲノム複製反応は栄養の枯渇によりすぐに停止してしまいます。従って、この人工細胞が進化することはありませんでした。そこで研究チームは、さらに細胞融合によりこの人工細胞に栄養を供給することを試みました。栄養となるたんぱく質群を含んだ水滴を外から添加し、人工細胞とともにかき混ぜることにより、人工細胞と栄養を含む水滴を融合させました。その結果、人工細胞は大きくなりますが、さらにかき混ぜることで、細胞は元のサイズに分裂しました。この細胞の融合と分裂を繰り返すことにより、半永久的に人工細胞内でゲノムRNAの自己複製を継続することに成功しました。
研究チームは、この人工細胞中でのゲノムRNAの複製を長期間繰り返しました。その結果、複製中に生じたエラーによりゲノムRNA中に突然変異が起こり、自然にゲノムRNAの多様性が生まれました。そして多様な性質を持つゲノムRNAの中に、より自身のコピー(子孫)を多く残すことができる適者が生まれると、その変異体は次第に元のRNAを駆逐していくことを発見しました。人工細胞の成長と分裂を継続的に50世代行うと、複製能力が約100倍に上昇し、ゲノムRNAには38個の変異が蓄積していました。これはまさにダーウィンの提唱した進化のメカニズムがこの人工細胞でも起きたことを意味しています。すなわち天然の細胞のように継代するだけで自発的に進化する能力を持つ人工細胞の作成に世界で初めて成功しました。
参考図
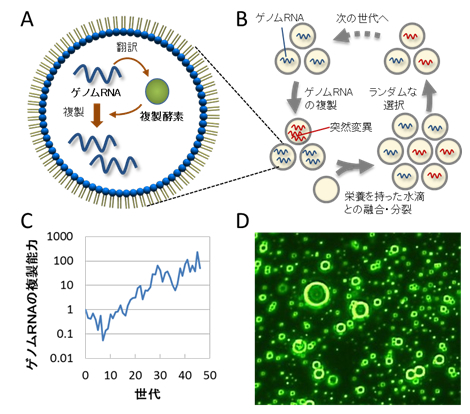
人工細胞におけるゲノムRNAの進化
油中水滴に封入されたゲノムRNAは自身にコードされた複製酵素により自己複製する(A)。この自己複製を、栄養を持った水滴との融合と分裂を繰り返すことにより、長期間継代した(B)。その結果、複製の中で複製エラーにより突然変異が導入されたことにより、変異型のゲノムRNAの中に元のRNAよりもより多くの子孫を残すものが現れ、その後の細胞の分裂とランダムな選択過程を経るにつれて元のRNAを駆逐するようになった。この過程を繰り返した結果、ゲノムRNAの複製能力は元の約100倍まで進化した(C)。融合直後の人工細胞の顕微鏡写真(D)。写真に写っている全ての輪、あるいは点は、サイズの異なる人工細胞である。
今後の展開
本研究で作成した人工細胞は、進化するための必要最低限の能力しか持っていません。この状態は、原始生命が初めて進化する能力を獲得した状態とよく似ています。今後、この人工細胞をさらに進化させることにより、原始生命がどうやって複雑な生命体へと進化することができたのかを、実験的に明らかにすることができると期待しています。この研究により、いままで謎に包まれていた生命の初期進化について新しい知見が得られると考えられます。
また、進化する能力を持つ人工細胞は、有用物質の生産などの効率化にも貢献できると考えています。現在、人類は食糧や薬剤の生産の多くを天然の生物に頼っています。しかし、天然の生物はいまだ解明されていない部分が多く、またその複雑さのために人間の都合に合わせて制御することが困難です。これに対し人工細胞は、全て既知物質から組み上げられているため、制御が容易で、自在にデザインすることができます。ここで構築した人工細胞を基盤にして、さまざまな遺伝子を導入し、その機能を進化させていくことにより、天然の生物より効率よく有用物質を生産できる人工細胞の作成につながると期待されます。
用語解説
- 注1)人工細胞
- はっきりした定義は成されていないが、一般的には細胞の機能の一部を人工的に再構成した細胞状の構造を人工細胞と呼ぶことが多い。本研究の人工細胞は、細胞の機能のうち、ゲノム複製、遺伝子翻訳、微小区画構造が人工的に再構成されている。
- 注2) 油中水滴
- 適切な界面活性剤の存在下で、水溶液を油の中で激しく混ぜると水溶液は微小な水滴として油の中に散らばる。この油の中の水滴は長期間安定で、内部でさまざまな反応を起こさせることができる。
記事引用元:http://www.jst.go.jp/pr/announce/20131003-2/index.html
人工細胞を使って膜たんぱく質を「進化」させる技術の開発
研究の背景と経緯
遺伝子操作などのバイオ技術が開発された当初、たんぱく質のある特定の部位に変異を導入すること(部位特異的変異導入法)により、自由にその機能を改変することや活性を強化できるようになるとの期待が高まりました。ところが現実には、たんぱく質内部の予想できない複雑な相互作用により、ある特定の部位への変異導入がたんぱく質のほかの部位へ影響を与えることになってしまい、目的とする機能への改変や活性の強化ができないばかりか、活性を大きく損なうことが少なくありませんでした。
そのような状況の中、1990年代になり、部位特異的変異導入法とは、全く異なる手法である進化分子工学的手法が考案されました。進化分子工学的手法は、ダーウィン進化を実験室で模倣することにより、変異と選択のステップを繰り返し行うことで生体高分子の性質を改変・改良していくという方法です。この手法は、遺伝子へのランダムな変異導入によって作られた10万から100万種類のたんぱく質を用意し、それぞれの性質に沿った選択を行うことにより、目的の性質を持つたんぱく質を得ることができます。こうして得られたたんぱく質に対して、さらに変異と選択を適用することにより、その目的に沿った性質を強化していくことができます。
この進化分子工学的手法は、10万から100万種類の翻訳されたたんぱく質とその遺伝子をそれぞれ個別に対応させる必要があります。このたんぱく質とその遺伝子を個別に対応させるための方法として、ファージと呼ばれる細菌に感染するウイルスを用いるファージディスプレイ法注2)やたんぱく質の翻訳を完全に終了させずリボソーム(ribosome)・たんぱく質・メッセンジャーRNAの複合体を用いるリボソームディスプレイ法(ribosome display)注3)などの手法が開発されてきました。
このような進化分子工学的手法は、可溶性たんぱく質に多く適用され、産業上有用なたんぱく質・酵素の創出などに貢献するとともに、たんぱく質の機能発現メカニズムの解明にも寄与してきました。
一方で、細胞がコードする遺伝子の20-30%は膜たんぱく質になります。膜たんぱく質は脂質二重膜である細胞膜表面に付着したり、細胞膜自体を貫通したりしている脂質二重膜と相互作用するたんぱく質です。
これらの膜たんぱく質には重要な働きを持つものが多数存在します。細胞外の物質が細胞表面に露出した膜たんぱく質に結合することにより、外部からのシグナルを細胞内部に伝達したり、細胞外のある特定の物質だけを内部に特異的に取り込みます。そして、インフルエンザやHIVなどウイルスの多くは、細胞表面のある特定の膜たんぱく質に吸着することにより細胞に感染を開始することなどから、製剤のターゲット分子の50%以上は膜たんぱく質であると言われています。しかし、ファージディスプレイ法やリボソームディスプレイ法では、異種たんぱく質の発現量が少ない、膜たんぱく質の発現によってファージが増殖できなくなる、膜たんぱく質は脂質二重膜に組み込まれていない状態では不安定で脂質二重膜に組み込まれていない状態での選択操作はできない、などの問題点がありました。そのため、これまでに膜たんぱく質は、進化分子工学の標的たんぱく質としてほとんど扱われてきませんでした。
研究の内容
膜たんぱく質を実験室で進化させるためには、まず合成する必要があります。一方、膜たんぱく質は、細胞内での発現量が少なく疎水領域が多いため、調製中に凝集体を形成しやすい、大量発現によって細胞毒性を示す、膜組成の違いによって異種発現たんぱく質が機能しないなど、試料調製を困難にする性質を持っています。
そこで研究チームでは、細胞サイズの人工脂質膜小胞リポソーム(liposome)の内部にたんぱく質合成に必要なものを全て埋め込んだ人工細胞を用いて、膜たんぱく質を合成しました。この人工細胞内で、遺伝子から膜たんぱく質をわずか数時間で合成することに成功しました。
次に、合成された膜たんぱく質は人工脂質膜に組み込まれることで、初めてその機能を発揮します。研究チームは人工脂質および人工細胞内の分子を工夫し、膜たんぱく質が脂質膜に組み込まれ、機能を発揮する条件を見いだしました。
さらに、遺伝子に人工的に変異を導入し、100万種類の多様な遺伝子の集団を作成しました。膜たんぱく質の機能を進化させるためには、膜たんぱく質の遺伝子の集団から、機能の高い膜たんぱく質の遺伝子を選択する技術が必要です。研究チームでは、機能の高い膜たんぱく質を発現した人工細胞は、より強い蛍光強度を示す実験系を確立し、蛍光セルソーターを用いて選択してくることに成功しました。この人工細胞を使って膜たんぱく質を実験室で進化させる技術を「リポソームディスプレイ法(liposome display)」と名付けました。
リポソームディスプレイ法の有効性を示すために、生体膜に穴を開ける膜たんぱく質「α-ヘモリシン(図1)」の実験室進化を行いました。まずは、リポソーム内部にα-ヘモリシンの遺伝子とたんぱく質合成に必要な全因子を入れ、人工細胞を構築します。この時、遺伝子の濃度を十分に低くすることで人工細胞のほとんどが遺伝子を含まず、一部の人工細胞のみが1つの遺伝子を含むようにします。2つ以上の遺伝子が入ってしまうと、高活性の遺伝子と低活性の遺伝子が混ざり合って、高活性の遺伝子活性が打ち消されてしまうからです。
このようにして作成した人工細胞を37度で反応させ、遺伝子からたんぱく質を合成すると、α-ヘモリシンの活性に応じて、脂質膜に穴が形成されます。次に、外部から蛍光物質を与えるとα-ヘモリシンの活性に応じて蛍光物質の取り込み量が増えるシステムを構築しました。蛍光物質は、α-ヘモリシンの穴を通してのみ人工細胞の内部に入り、穴の数が多い人工細胞ほどより多くの蛍光物質を取り込みます。蛍光物質は人工細胞の内部で巨大分子と共有結合するようにシステムを構築したので蛍光物質は人工細胞の内部には流入しても、外部へ漏れ出しません。これにより、蛍光物質が一方通行で時間とともに蓄積していくため、人工細胞の蛍光を高感度に検出できます。
最も多くの蛍光物質を取り込んだ人工細胞を、蛍光セルソーターで選択・分取しました。分取された人工細胞からは高機能型の遺伝子が得られ、その遺伝子を用いて再度人工細胞を作製して同様の作業を繰り返します。これらの作業を20回繰り返した結果、野生型よりも約30倍も脂質膜に穴を開ける能力の高い変異体の取得に成功しました。
この方法は、α-ヘモリシン以外の複数の膜たんぱく質でも合成可能で、それらのたんぱく質が人工脂質膜に組み込まれることも示しており、このことはリポソームディスプレイ法がさまざまな膜たんぱく質の実験室進化に利用できる可能性を示唆しています。
参考図
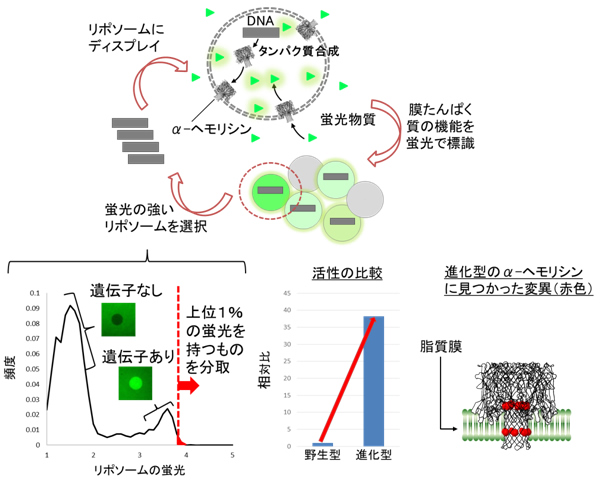
リポソームディスプレイによるα-ヘモリシンの「進化」
α-ヘモリシンの遺伝子に人工的に変異を導入します。この遺伝子をリポソーム内部に封入すると、α-ヘモリシンのたんぱく質が合成されます。合成されたたんぱく質はリポソームの脂質膜に刺さり、小さな穴を開けます。穴の数が多い程、より多くの蛍光物質が流入します。より多くの蛍光物質を流入させたリポソームを分取し、内部のDNAを取り出して同様の作業を繰り返すと、穴を形成しやすい遺伝子が得られます。左下のグラフは実際に蛍光輝度と頻度を表したヒストグラムです。遺伝子が入っていないリポソームは暗く、遺伝子が入っているリポソームは明るいことが分かります。明るいリポソームの中でも特に蛍光輝度が高いリポソームを分取します。中央下のグラフは本研究によって得られた「進化」型と野生型の膜たんぱく質活性を測定した結果です。右下の図は進化型のα-ヘモリシンを解析した結果、変異が見つかった部位を赤色で示しています。ちょうど脂質膜に組み込まれる部分に変異が集中している様子が見られます。
今後の展開
進化分子工学を用いた可溶性たんぱく質の機能改変のため、1990年代からさまざまなディスプレイ技術が開発されてきました。現在、これらの技術は世界中で利用されバイオ医薬品の開発など、学術のみならず産業界においても大きな成果を上げています。
本研究成果は、従来のディスプレイ技術では扱えなかった膜たんぱく質を対象とするディスプレイ法が日本から世界へ発信されることになります。リポソームディスプレイによりさまざまな機能を改変、もしくはより高機能化した「便利な膜たんぱく質」を構築することが可能になるため、高性能バイオセンサーの開発などにも寄与すると思われます。ほかにも膜たんぱく質に強く結合することによりその機能を阻害する新たな薬の発見など、多方面への波及効果が期待されます。研究グループではすでにリポソームディスプレイ法に関する特許出願を済ませており、今後、産業界と連携して膜たんぱく質の産業利用など多方面への展開が期待されます。
用語解説
- 注1) 人工細胞
- はっきりした定義は成されていないが、一般的には細胞の機能の一部を人工的に再構成した細胞状の構造を人工細胞と呼ぶことが多い。本研究の人工細胞は、細胞の機能のうち、たんぱく質合成に必要なものを全て持ち、その系による遺伝子翻訳、脂質二重膜による微小区画構造が人工的に再構成されている。
- 注2) ファージディスプレイ法
- ランダムに変異を導入した遺伝子をファージ内でたんぱく質に翻訳させ、この際、翻訳されたたんぱく質は、ファージ表面に露出するように設計を行っている。ファージ1つに対して1種類の遺伝子が導入されるように調整することにより、1種類のたんぱく質をその表面に露出した10万から100万種類のファージの集団が得られるようにする。このファージの集団に対して、選択操作を行うことにより、目的の性質を持つたんぱく質が得られるとともに、その目的の性質を持つたんぱく質の遺伝子が得られることになる。このような変異・選択のサイクルを繰り返すことにより、目的に応じて「進化」させたたんぱく質あるいは遺伝子を得るための手法。
- 注3) リボソームディスプレイ法(ribosome display)
- たんぱく質翻訳に必要なものを細胞から取り出し、実験室でRNAを加えるだけでたんぱく質が翻訳されるように調製した無細胞翻訳系というものを用いる方法。末端に翻訳が停止するような特殊な配列を付加した10万から100万種類の遺伝子を無細胞翻訳系で翻訳を行うことにより、1種類のたんぱく質が固定された10万から100万種類のリボソーム・たんぱく質・メッセンジャーRNAの複合体を得る。この複合体の集団に対して選択操作を行い、たんぱく質の性質に応じての選択操作により、目的の性質を持つたんぱく質を得るとともに、その目的の性質を持つたんぱく質の遺伝子が得られることになる。このような変異・選択のサイクルを繰り返すことにより、目的に応じて「進化」させたたんぱく質あるいは遺伝子を得るための手法。
記事引用元:http://www.jst.go.jp/pr/announce/20131001-2/index.html
原始細胞の分裂・増殖の過程の謎に迫る—人工細胞の構築・デザインへの応用に期待—
研究の内容
これまで、たんぱく質などを含まない単純な物質でモデル膜の分裂・増殖を試験管の中で再現する場合、膜に力を加えて剪断するなど、外部からの操作を必要としていました。今回研究チームは、膜の中に内封する物質の挙動に着目し、膜分裂が自発的に起こる可能性を検討しました。
具体的には、原始細胞のモデルとしてリン脂質で構成された膜小胞を用い、これらの内部に高分子を内封した場合の膜の挙動を観察しました。
まず、細胞の成長を模倣するステップとして、電気パルスにより膜小胞を融合させて、融合前の状態よりも体積に対する膜面積が増加している状態を作り出しました。原始の環境では放電が起こっていたと考えられることから、電気刺激による細胞膜の融合は自然に起こり得たと考えられます。
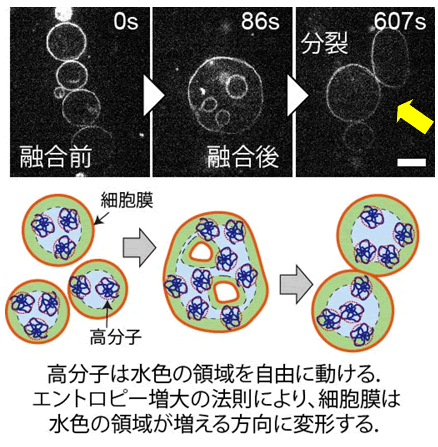
リン脂質膜小胞内に何も含まれていない場合、融合により膜の面積が増加すると、膜小胞の中に小さな小胞が形成されたものの、それ以上の変化は見られませんでした。一方、分子量6000ダルトンのポリエチレングリコール(高分子)を3%の重量濃度で含む膜小胞では、融合後しばらくすると自発的に膜小胞が変形してくびれが生じ、分裂する様子が観察されました(図上段:矢印は膜小胞のくびれ)。
この分裂現象は、エントロピー増大の法則(図下段)に従って膜が変形することにより引き起こされるもので、このメカニズムは、モデル系に用いられている分子の化学的性質によりません。このことから、原始細胞がどのように増殖し得たのかという議論において、広範に適用することができるメカニズムであると考えられます。
参考図
※以下のリンクから、動画の閲覧が可能です
http://youtu.be/sY64KXAexIA
http://youtu.be/OCqvxpDAo-o
発見により期待される成果
原始的な細胞が誕生し進化した過程は現代において見ることができないため、さまざまな説が提唱されています。本研究の成果は、これまで多くの研究者が挑んできた、遺伝物質を包む細胞膜がどのように増殖し得たか、という謎に対する1つの可能性を示すものです。
生命の最小単位である細胞は、さまざまな反応を協調的に進行させ、高感度・高選択性で物質を感知するなど、高度で複雑な機能を備えています。近年、細胞を高性能な化学反応の場ととらえ、この微小な反応場を試験管内で再構成し、効率的な有用物質生産や高感度の環境センサーなどに応用しようとする試みが盛んに進められています。
細胞は分裂、増殖、変異を繰り返すことで、進化的に内外の環境に適応し、高度な機能を獲得してきたと考えられており、原始細胞における増殖と進化の過程を理解することは、既知の材料をもとに細胞の持つ機能を試験管内で再構成する(人工細胞を構築する)ためにも重要な知見です。
今回発見された分裂現象は物理的効果のみで再現できるものであることから、人工細胞を構築する際に、細胞膜が成長して分裂する機構をデザインする基礎となることが期待されます。
用語解説
注1) エントロピー増大の法則
熱力学の第二法則。分子(この場合は高分子)の配置の場合の数がより多くなる方向に状態が変化すること。
記事引用元:http://www.jst.go.jp/pr/announce/20120403/index.html
