- JST トップ
- /
- 戦略的創造研究推進事業
- /
 ERATO
ERATO- /
- 研究領域の紹介/
- 終了領域/
- 村田脂質活性構造プロジェクト
村田脂質活性構造プロジェクト

研究総括 村田 道雄
(大阪大学 大学院理学研究科 教授)
研究期間:2010年10月~2016年3月
特別重点期間:2016年4月~2017年3月
グラント番号:JPMJER1005
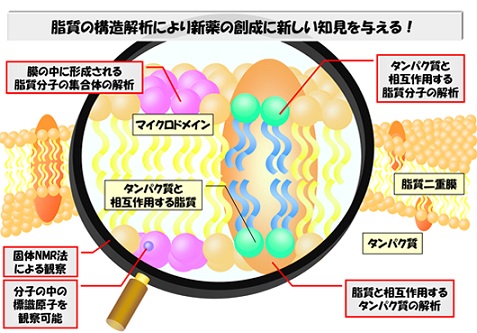
脂質は、細胞の内と外を隔てる生体膜の主要な構成成分です。この脂質がタンパク質と相互作用して、脂質-タンパク質複合体を作ることで、必要に応じて物質を取り込んだり排出したりする生体膜の機能が保たれています。これまでに生体膜中のタンパク質構造・機能については多くの研究がなされてきました。一方、脂質については、生体膜中の脂質構造を知る手法が少ないために進展しておりませんでした。しかし脂質も膜タンパク質と相互作用することによって重要な機能を担うことが知られるようになったため、薬などの開発現場においては脂質構造の解明が重要な課題となってきています。
このプロジェクトでは、1)生体膜中でリガンドとなる脂質分子を同位体で標識しながら合成し、2)リガンドの膜タンパク質との相互作用を固体NMRにて解析します。同時に、3)標識したリガンドと結合したタンパク質の構造をX線結晶構造解析で調べることで、これまでの構造解析では明らかにされてこなかった脂質の活性配座を明らかにします。このように、有機合成化学、タンパク質工学をはじめとし、計算科学、X線結晶構造解析、固体NMRなどの技術を駆使することによって、脂質の立体構造という観点から脂質―タンパク質相互作用を統一的に理解することを目指します。
研究成果の概要
構造生物学の発展によってタンパク質の構造と機能における科学的理解は大きく進みました。一方で、生体膜を構成する脂質分子に関しては、未だ十分に解明が進んでいるとはいえないのが現状です。本プロジェクトでは、脂質分子が実際に機能している状態の動態や構造を解明することによって、生体膜研究の研究基盤を作ることを目的としました。生体モデル膜を使った化学的アプローチで、従来では困難であった脂質分子の動的挙動の解析に成功しました。また、タンパク質と脂質との構造的相互作用解析では、脂肪酸とタンパク質の相互作用に水分子が重要な役割を果たしていることを明らかにしました。更に、脂質分子は難水性であるため、正確なタンパク質との結合活性やX線共結晶構造解析が困難でしたが新たな手法を開発することで可能としました。本プロジェクトの成果は、生命現象の学術的理解を深めただけでなく、医学の進歩や医薬品の開発へも貢献するものと期待されます。
研究成果
A. 固体NMRと同位体標識分子を活用した脂質の動的挙動解析
NMRと化学合成による同位体標識を組み合わせることによって、スフィンゴミエリン(SM)動的構造解析を行い、SMのラフト形成解明に成功しました。本研究は膜の固体NMRと、その解析に有用な脂質標識プローブ分子の開発と有機合成を併用して初めて可能となったもので、このようなアプローチはこれまでまったく研究例がありません。本実験により、今後の脂質膜の分子動力学シミュレーションの進歩に必要な信頼性の高い実験パラメータを供することができ、膜タンパク質の今後の更なる研究の発展が期待されます。
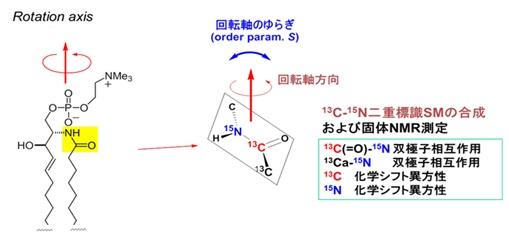
SMアミドの配向解析
- Orientation and order of the amide group of sphingomyelin in lipid bilayers determined using solid-state NMR. Nobuaki Matsumori, Toshiyuki Yamaguchi, Yoshiko Maeta, Michio Murata. Biophys. J. 2015, 108 (12), 2816-2824.
- Deuterium NMR of raft model membranes reveals domain-specific order profiles and compositional distribution. Tomokazu Yasuda, Hiroshi Tsuchikawa, Michio Murata, Nobuaki Matsumori. Biophys. J. 2015, 108, 2502-2506.
- Phosphatidylcholine bearing 6’, 6’-didueterated oleic acid, a useful solid-state 2H NMR probe for investigating membrane properties. Jin Cui, Sébastian Lethu, Tomokazu Yasuda, Shigeru Matsuoka, Nobuaki Matsumori, Fuminori Sato, Michio Murata. Bioorg. Med. Chem. 2015, 25(2), 203-206.
- Formation of gel-like nanodomains in cholesterol-containg sphingomyelin or phosphatidylcholine membrane as examined by fluorescence lifetimes and 2H NMR spectra. Tomokazu Yasuda, Nobuaki Matsumori, Max Lönnfors, Thomas, K. M. Nyholm, J. Peter. Slotte, Michio Murata, M. Langmuir 2015, 31(51), 13783-13792.
B. ラマンイメージング法を用いたラフト相での脂質分子の分布解析
ラフトモデル膜でのプローブ分子の分布をラマンイメージングによって、細胞膜上の重要な領域であるラフトのモデル膜を用い、ラマン散乱顕微鏡を活用することで、初めて脂質(SM)プローブ分子の分布を可視化することに成功しました。その結果は、SM濃度がラフト領域の中心から外側へと”徐々に”減少していくもので、これまでに想像されてきたラフトモデル、すなわちラフトの二相分離とは異なる描像を提起しています。この成果は、今後の脂質膜の分析や動態の解明への貢献に期待されます。
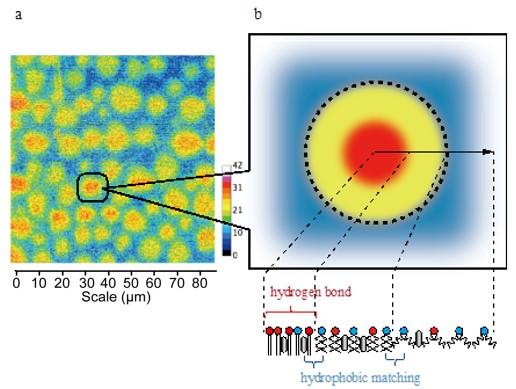
ラマン散乱の信号強度が高いほど、SMアナログの濃度が高い
- Sphingomyelin distribution in lipid rafts of artificial monolayer membranes visualized by raman microscopy. Jun Ando, Masanao Kinoshita, Jin Cui, Hiroyuki Yamakoshi, Kosuke Dodo Katsumasa Fujita, Michio Murata, Mikiko Sodeoka. Proc. Natl. Acad. Sci. USA 2015, 112 (15) 4558-4563.
- Novel Raman-Tagged Sphingomyelin that Closely Mimics Original Raft-Forming Behavior. Jin Cui, Shigeru Matsuoka, Masanao Kinoshita, Nobuaki Matsumori, Fuminori Sato, Michio Murata, Jun Ando, Kosuke Dodo, Mikiko Sodeoka. Biorg. Med. Chem. 2015, 23(13), 2989-2994.
C. 脂質とタンパク質の構造的相互作用解析
タンパク質(FABP3)が脂質分子を認識する機構の解明のため、新規に難水性の脂肪酸とFABP3との結合活性を解析する手法を開発しました(図1)。また大型放射光施設SPring-8を利用して得た超高分解能X線結晶構造(図2)を基に分子動力学計算も行いました。その結果、FABP3は、結合ポケット内の水分子を巧みに利用して、水に溶けない脂肪酸の長さを見分けることが明らかになりました(図3)。脂肪酸のわずかな構造の違いを正確に見分けるタンパク質のしくみは、脂肪酸が関連する循環器疾患や精神疾患の分子メカニズム解明と医薬分子設計に役立つ重要な知見にもなります。
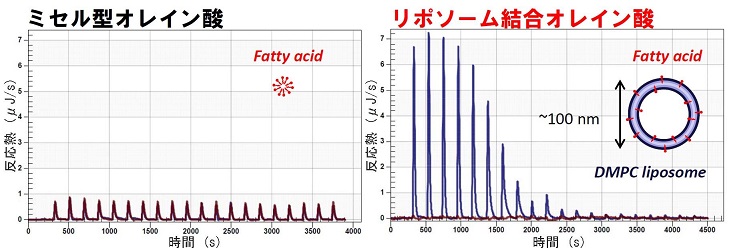
図1.脂肪酸を懸濁液として滴下した場合は反応が見られなかったが(左)、リポソームに結合して添加した場合はFABP3-脂肪酸結合に伴う反応熱が明確に観測された

図2.高分解能で長鎖脂肪酸の構造を決定した
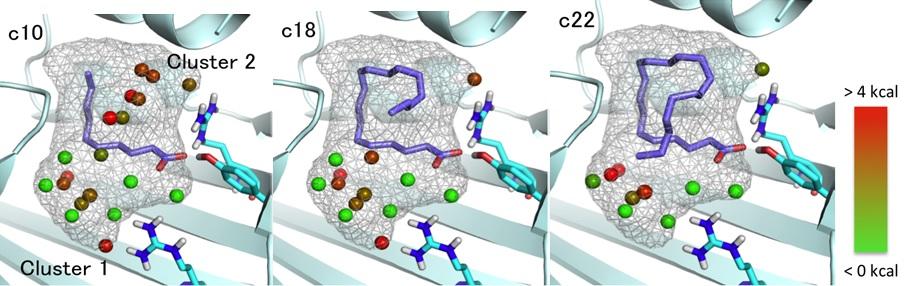
図3.3種の長さの脂肪酸のFABP3の結合ポケット内の構造と水分子の配置とエネルギー値
- Water-mediated recognition of simple alkyl chains by heart-type fatty acid-binding protein. Shigeru Matsuoka, Shigeru Sugiyama, Daisuke Matsuoka, Mika Hirose, Sébastien Lethu, Hikaru Ano, Toshiaki Hara, Osamu Ichihara, S. Roy Kimura, Satoshi Murakami, Hanako Ishida, Eiichi Mizohata, Tsuyoshi Inoue, Michio Murata. Angew. Chem. Int. Ed. 2015, 54(5) 1508-1511.
- Molecular dynamics simulations of heart-type fatty acid-binding protein in apo and holo forms, and hydration structure analyses in the binding cavity. Daisuke Matsuoka, Shigeru Sugiyama, Michio Murata, Shigeru Matsuoka. J. Phys. Chem. B. 2015, 119 (1), 114-127.
- Stereoselective synthesis of head group of archaeal phospholipid PGP-Me for investigating bacteriorhodopsin-lipid interactions. Jin Cui, Satoshi Kawatake, Yuichi Umegawa, Sébastien Lethu, Shigeru Matsuoka, Fuminori Sato, Nobuaki Matsumori, Michio Murata. Org. Biomol. Chem. 2015, 13(41), 10279-10284.
D. 凝固ゲル中結晶化技術を用いる難水性化合物とタンパク質の複合体X線構造解析
水に溶けにくい脂質などの化合物はタンパク質との共結晶化が困難です。これを解決するため、新しい凝固ゲル中結晶化手法の開発に成功しました。本技術によって、従来困難視されていた難水溶性リガンドの結合構造解明に大きく道を開いたことは特筆に値します。具体的には、膨大な化合物ライブラリーから新薬候補化合物を探し出す全く新しい「創薬スクリーニング」への応用へ向けた第一歩にもなると期待しています。
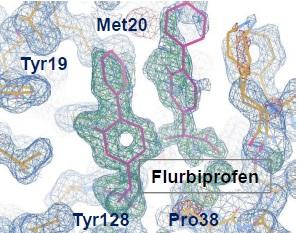
図1.FABP3-脂溶性薬剤複合体の立体構造












