- JST トップ
- /
- 戦略的創造研究推進事業
- /
 ERATO
ERATO- /
- 研究領域の紹介/
- 終了領域/
- 加藤核内複合体プロジェクト
加藤核内複合体プロジェクト
※本プロジェクトの研究総括であった加藤茂明氏については、同氏が主宰する研究室において論文の不正行為があったことが東京大学において認定されています。認定された不正行為には、本プロジェクトの研究成果とされた論文の一部が含まれています。詳細は、下記をご参照下さい。
http://www.u-tokyo.ac.jp/public/public01_261226_j.html
http://www.u-tokyo.ac.jp/content/400007786.pdf
http://www.jst.go.jp/osirase/20160325_oshirase-2.html
 研究総括 加藤 茂明
研究総括 加藤 茂明
(東京大学 分子細胞生物学研究所 教授)
研究期間:2004年10月~2009年9月
研究および研究成果概要
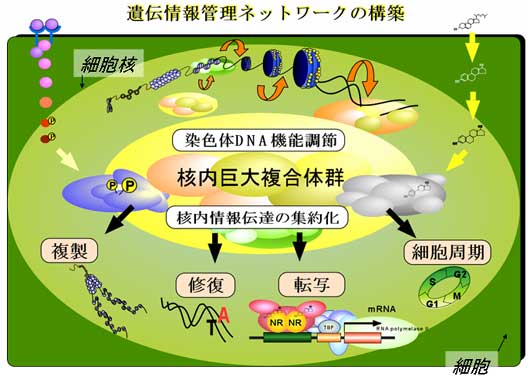
人体を構成する数十兆にも及ぶ細胞群は、時間的・空間的な制御に加え、刻々と変化する環境にも適応し、生命を支えています。
ヒトゲノム計画で全DNA塩基配列が解読されましたが、塩基配列情報だけでは人体の複雑な生命現象を説明することが出来ていません。すなわち、必要とする遺伝情報だけを特定の時間・細胞・組織で、染色体から読み出す仕組みを理解することが重要となってきています。我々は、このような遺伝情報の読み取りに関与する、様々な細胞核内の巨大タンパク質複合体を精製・同定し、その生理機能を解析してきました。
その結果、これら核内複合体は、選択的な遺伝情報管理において中心的な役割を果たすエピゲノム制御因子(DNA塩基配列を変化させずに遺伝子の働きを制御する因子)として機能していることなどを次々に明らかにすることに成功しました(1.-5.)。本プロジェクトの成果は、学際的な価値だけでなく、iPS細胞などの再生医療、新規薬剤・治療法の開発研究など産業的な応用も期待でき、新規領域:「選択的ゲノム制御工学」としての展開が期待されます。
- Ohtake F, et al., Nature 446, 562-66 (2007).
- Nakamura T, Imai Y, et al., Cell 130, 811-823 (2007).
- Takada I, et al., Nat Cell Biol. 9, 1273-1285 (2007).
- Fujiki R, et al., Nature 459, 455-459 (2009).
- Kim M, et al., Nature 461, 1007-1012 (2009).
研究成果集
A: 新たな脂溶性リガンドの分子作用機構の解明
ダイオキシン受容体(AhR)と性ホルモン受容体群との機能的クロストークの分子機構の解明の過程で、AhRがユビキチンE3リガーゼ複合体の主要構成 因子であることを証明した。これはAhRリガンドとして作用する人工化合物・毒物・薬物が、遺伝子発現制御だけでなく、細胞内のタンパク分解を調節するこ とで各種の特徴的な生理作用を発揮する経路の存在を初めて証明したものである。
他の核内受容体について同様な解析を始めているが、実際いくつかの核内受容体で同様のユビキチンリガーゼの活性を見出しつつあり、AhRのみならず、核内受容体群が脂溶性リガンドによる標的タンパク質の分解制御を行う調節因子である可能性を示すものである。
- Ohtake F, Baba A, Takada I, Okada M, Iwasaki K, Miki H, Takahashi S, Kouzumenko A, Nohara K, Chiba T, Fujii-Kuriyama Y and Kato S. Dioxin receptor is a ligand-dependent E3 ubiquitin ligase. Nature 446, 562-66 (2007)
B: 骨粗鬆症発症の分子基盤の解明
閉経期後の女性における骨粗鬆症は、先進諸国において社会的問題として顕在化しつつある。骨粗鬆症による骨量減少は最も重大な骨折の危険因子であるため、骨粗鬆症の発症抑制・治療は重要な社会的課題である。
各種実験アプローチや臨床的観察から、骨粗鬆症発症の主要因は、女性ホルモン欠乏であることが明確に示されているにもかかわらず、女性ホルモンの骨防御作用については長い間不明であった。我々は、マウスを用いた分子遺伝学的アプローチにより、破骨細胞特異的にエストロゲン受容体(ER)を破壊した雌マウスにおいて、骨粗鬆症様の骨変異が 生じることを見出した。更に遺伝子レベルでの解析により、女性ホルモンは、破骨細胞内のERに結合することによって、細胞死の一種であるアポトーシスを引 き起こす因子:Fas Ligandの遺伝子発現を亢進させ、破骨細胞の寿命を短縮する作用があることを突き止めた。すなわち女性ホルモンは、破骨細胞数を減少させることで、骨吸収に対し抑制的に作用し、骨防御作用を発揮していることを証明した。
本成果は、長い間不明であった女性ホルモンの骨防御作用の分子機構を明らかにしただけでなく、創薬や臨床的治療の材料として大きな貢献が期待される骨粗鬆症自然発症モデルを提供するものである。
- Nakamura T, Imai Y, Matsumoto T, Sato S, Tekeuchi K, Igarashi K, Harada Y, Azuma Y, Krust A, Yamamoto Y, Nishina H, Takeda S, Takayanagi H, Metzger D, Kanno J, Takaoka K, Martin T.J, Chambon P and Kato S. Estrogen prevents bone loss via estrogen receptor α and induction of fas ligand in osteoclasts. Cell 130, 811-823 (2007)
C: 骨と脂肪のバランスを制御するメカニズムを解明
骨髄に存在する間葉系幹細胞注は脂肪細胞や骨芽細胞、筋芽細胞など多様な細胞への化能を有し、生体の骨、筋肉、脂肪量を調節している。しかし、肥満や骨 粗鬆症などの病態ではこの分化バランスが崩れていることが報告されており、分化を制御するメカニズムの解明が待たれていた。
我々は、脂肪細胞を増やすPPARγの機能抑制因子の同定を試みた。その結果、細胞外分泌タンパク質であるWnt5aが核においてリン酸化酵素:NLK を活性化し、PPARγ機能を抑制することを見出し、さらにNLKがヒストン修飾酵素:SETDB1の機能を制御することで染色体のクロマチン構造注を変 化させ、間葉系幹細胞の分化を制御していることを突き止めた。
本成果は、これまで不明確であった骨芽細胞・脂肪細胞への分化・振り分けのメカニズム、および老化や骨粗鬆症に伴って起こる骨組織中の脂肪細胞蓄積の原 因の一端を解明しただけでなく、Wnt5aやNLKの活性制御物質は肥満改善や骨量増加作用が期待でき、肥満・骨粗鬆症などの治療薬開発の一助になるもの と思われる。
- Takada I, Mihara M, Suzawa M, Ohtake F, Igarashi M, Takeyama K, Nakamura T, Mezaki Y, Takezawa S, Yogiashi Y, Kitagawa H, Yamada G, Takada S, Minami Y, Shibuya H, Matsumoto K, Kato S. A histone lysine methyltransferase activated by non-canonical Wnt signaling suppresses PPAR-γtransactivation. Nat Cell Biol. 9, 1273-1285 (2007)
D: 核内糖付加反応の生理的重要性の解明
古くから、細胞核内にはNアセチルグルコサミン(GlcNAc)付加反応が存在し、GlcNAc付加反応はO-GlcNAc transferase (OGT)によって触媒されることが報告されていた。このGlcNAc付加反応は遺伝子発現制御に関与することも知られていたが、その分子機構は全く不明 であった。
我々は、レチノイドに反応して顆粒球細胞へ分化するHL60細胞の核抽出液を用いて、レチノイド受容体に結合するエピゲノム制御因子群を網羅的に検索した。その結果MLL5を含む新規複合体を同定し、複合体構成因子の一つがOGTであることを証明した。OGTはMLL5をGlcNAc化することで、 MLL5のヒストンH3K4のメチル化酵素活性やMLL5複合体形成能を誘導することを見出した。これは、生理的機能が不明であった核内における糖付加反 応の意義を明らかにするものであり、核内単糖付加のエピゲノムにおけるインパクトを証明したものである。さらに、このGlcNAc化は細胞外のグルコース濃度に依存するため、核内の糖付加反応が糖尿病を始めとした代謝性疾患と関連する可能性を初めて指摘する成果である。
- Fujiki R, Chikanishi T, Hashiba W, Ito H, Takada I, Roeder RG, Kitagawa H and Kato S. GlcNAcylation of a histone methyltransferase in retinoic-acid-induced granulopoiesis. Nature 459, 455-459 (2009)
E: 新たなエピゲノム制御としてのDNA脱メチル化経路の証明
ほ乳類では、一度メチル化されたDNAは脱メチル化されず、細胞分裂に伴うDNA複製時にのみDNA脱メチル化が起こると考えられてきた。また、積極的なDNA脱メチル化に関する観察報告は散見されてきたが、その分子機構は不明であったため、長い間疑問視されてきた。
我々は、ビタミンD刺激によって形成される転写抑制複合体の解析により、この複合体に、メチル化したDNAを認識・結合しDNAグリコシル化活性を有するMBD4と、DNAメチル化酵素が含まれていることを見出した。実際、ビタミンD刺激によってCYP27B1プロモーターのメチル化が促進し転写が抑制 され、逆に、CYP27B1遺伝子の転写を誘導するPTH処理は、MBD4を介してDNA脱メチル化を誘導することを明らかにした。すなわちMBD4は、PTHシグナルの下流に位置するPKCによってリン酸化を受けて活性化しメチル化DNAをグリコシル化すること、このグリコシル化 に続いて典型的な塩基除去経路が働き、DNA脱メチル化が完成することを証明した。
本研究により、これまで疑問視されていたほ乳類でのDNA脱メチル化反 応の存在、及びその分子機構の実態を証明することができた。
- Kim M, Kondo T, Takada I, Youn M, Yamamoto Y, Takahashi S, Matsumoto T, Fujiyama S, Shirode Y, Yamaoka I, Kitagawa H, Takeyama K, Shibuya H, Ohtake F and Kato S. DNA demethylation in hormone-induced transcriptional derepression. Nature 461, 1007-1012 (2009)
F: 超巨大複合体の存在の証明
これまでに報告した核内巨大複合体群は、生化学的手法により見出すことのできたサイズの複合体群であるが、当初の予想通り、想像を超える超巨大複合体の存在を証明できつつある。この複合体は従来の巨大複合体に比較して数倍のサイズと推測され、電子顕微鏡等の可視的アプローチで検出できる細胞内小器官と、生化学的に同定できる複合体群との狭間に位置するサイズと考えられる。その機能については現在も解析を継続中である。現時点でどの程度の大きさの超巨大複合体が存在するか否かは明らかではないが、今後も超巨大複合体の同定を試みる予定である(Fujiyama-Nakamura S. et al., in preparation)。
一方、ベイバイオサイエンス(株)との共同研究により、超巨大複合体を分画する新たな機器の開発を試み、セルソーターの原理を応用したタンパク質複合体 分画法の基盤技術を確立し、特許化した。この技術により、セルソーターの著しい高感度化を達成することができ、新たな細胞工学技術の一つとして注目される と考えられる。












